【题目】在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是
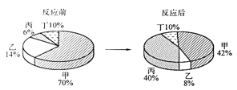
A. 丙一定是单质 B. 该反应一定是化合反应
C. 反应中甲、乙的质量比为5∶1 D. 丁一定该反应的催化剂
参考答案:
【答案】B
【解析】由四种物质反应前后各物质的质量分数可知,在反应前后,甲的质量分数减少了70%-42%=28%,甲是反应物;乙的质量分数减少了14%-8%=6%,乙是反应物;丙的质量分数增加了40%-6%=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。A、由上述分析,该反应的反应物为甲和乙,生成物是丙,该反应是由两种物质生成一种物质,属于化合反应,丙一定是化合物,不可能是单质,错误;B、、由上述分析,该反应的反应物为甲和乙,生成物是丙,该反应是由两种物质生成一种物质,属于化合反应,正确;C、由上述分析,参加反应的甲和乙的质量比为28%:6%=14:3,错误; D、丁的质量分数不变,可能没有参加反应,也可能用作该反应的催化剂,不一定是该反应的催化剂,错误。故选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,如图1所示为该小组配制10%的氢氧化钠溶液的操作过程:
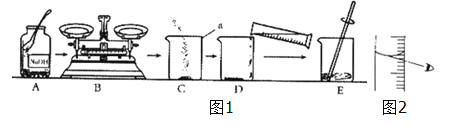
(1)图1中仪器a的名称是 ,写出该仪器的另一种用途 ;
(2)操作B中,必须将氢氧化钠固体放在 里,并置于托盘天平 盘(填“左”或“右”)进行称量;
(3)操作D中,用量筒量取所需体积的蒸馏水时还用到 (填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数 (填写“偏大”、“偏小”或“无影响”).
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上 .
(5)制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是 (填写字母标号)
a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
-
科目: 来源: 题型:
查看答案和解析>>【题目】在进行“二氧化碳制取和性质”的分组实验过程中,某实验小组设计了如图
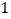 (左a右b)两套制取二氧化碳的装置:
(左a右b)两套制取二氧化碳的装置: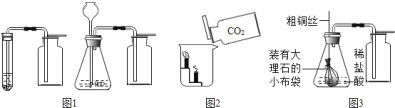
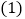 你认为设计合理的是________(填字母序号),实验室制取二氧化碳的化学反应方程式为:________;
你认为设计合理的是________(填字母序号),实验室制取二氧化碳的化学反应方程式为:________; 用正确的装置制取一瓶二氧化碳后,乙同学做了如图
用正确的装置制取一瓶二氧化碳后,乙同学做了如图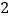 所示验证二氧化碳性质的实验,请和实验小组的同学一起完成下列实验报告册的填写:
所示验证二氧化碳性质的实验,请和实验小组的同学一起完成下列实验报告册的填写:实验现象
_________
实验结论
________
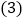 实验结束后反应还在继续,丙同学觉得浪费了化学药品,于是对上述装置进行了如图
实验结束后反应还在继续,丙同学觉得浪费了化学药品,于是对上述装置进行了如图 所示的改进.请回答:
所示的改进.请回答:丁同学认真分析后,觉得该装置还可以用来制取氧气,写出用该装置制取氧气的化学反应方程式:________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钛
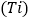 是
是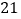 世纪最重要的金属之一.某化学兴趣小组的同学为探究铝、铜、钛的金属活动顺序,做了如下实验:①先用砂布将金属表面擦光亮.②将大小、厚薄相同的三种金属片分别放入到盛有相同体积的同种盐酸的试管中,观察到的现象如下:
世纪最重要的金属之一.某化学兴趣小组的同学为探究铝、铜、钛的金属活动顺序,做了如下实验:①先用砂布将金属表面擦光亮.②将大小、厚薄相同的三种金属片分别放入到盛有相同体积的同种盐酸的试管中,观察到的现象如下:金属
钛
铝
铜
与盐酸反应的现象
放出气泡缓慢
放出气泡快
无现象
 依据上表现象推断三种金属的活动性顺序从强到弱为:________,把金属钛放在硫酸铜溶液中能否发生反应?________(填“能”或“不能”);
依据上表现象推断三种金属的活动性顺序从强到弱为:________,把金属钛放在硫酸铜溶液中能否发生反应?________(填“能”或“不能”); 根据三种金属的性质和用途回答:①建筑常用铝合金做门窗,原因是________(答
根据三种金属的性质和用途回答:①建筑常用铝合金做门窗,原因是________(答 点);
点); -
科目: 来源: 题型:
查看答案和解析>>【题目】从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质。
(1)锂原子的结构示意图为
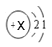 ,则x=_______,在元素周期表中锂元素位于_________周期,在化学反应中锂原子易_________________(填“得到”或“失去”)电子。
,则x=_______,在元素周期表中锂元素位于_________周期,在化学反应中锂原子易_________________(填“得到”或“失去”)电子。(2)硫原子得到2个电子形成离子,其离子符号为________________。
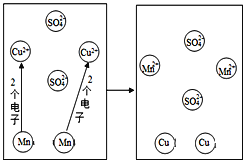
(3)下图为锰(Mn)和CuSO4溶液反应的示意图(锰离子符号为Mn2+),回答下列问题:
①反应中Mn与Cu2+的个数比为____________。
②反应中失去电子的粒子是_____________。硫酸铜中硫元素化合价为_________。
③由反应可知金属的活泼性:Cu_________Mn(填“>”或“<”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类的生产、生活离不开化学。
(1)生活中去除油污的方法很多,其中洗涤剂去油污是利用了洗涤剂的_____ 作用。
(2)打开汽水瓶盖,发现汽水会自动喷出来,说明气体的溶解度与___________有关;喝了汽水后,常常打嗝,说明气体的溶解度还与__________有关。
(3)汽车表面喷漆不仅美观,而且可有效防止车体与空气中的_____________接触而生锈。工业上常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为______。
(4)与纯金属相比,合金具有更多优良性能,如黄铜比纯铜硬度____________(填“大”或“小”)。
(5)工业炼铁过程中常用一氧化碳还原赤铁矿(主要成分为氧化铁),该反应的化学方程式为__________,炼铁过程中焦炭的主要作用有_______(填一点即可)
(6)为了证明银、铜、铝三种金属的活动性,可选用铜丝、硝酸银溶液和____溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室从含有 CuSO4、ZnSO4、FeSO4的废液中回收工业原料硫酸锌和有关金属的流程如下:
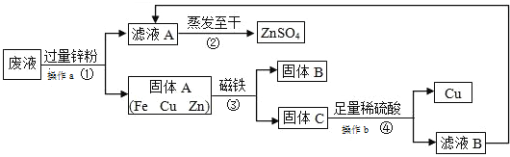
请回答:
(1)操作a、操作b均为__________,该操作用到的玻璃仪器为_____、玻璃棒、烧杯。
(2)滤液 A 和滤液 B 含有相同的溶质,其名称是_____;固体 B 的化学式为_____。
(3)步骤①中加入过量锌粉的目的让废液中的_______完全反应;步骤④加入足量稀硫酸有气泡产生,反应的化学方程式为__________。
(4)该流程中发生的置换反应共有__________个。
相关试题

