【题目】已知:Mg(OH)2 = MgO+H2O。一定质量的Mg(OH)2和MgO的混合物加热一段时间后,将生成的气体通入到浓硫酸中,增重1.8g,已知剩余固体的质量为13.8g,剩余固体中Mg元素的质量为7.2g,下列说法错误的是
A. 剩余固体为混合物
B. 原混合物中Mg元素的质量为7.2g
C. 混合物中Mg(OH)2与MgO的质量之比为29∶20
D. 加热前后的固体分别与相同浓度稀盐酸恰好完全反应所消耗盐酸质量相等
参考答案:
【答案】C
【解析】氧化镁中镁元素质量分数是![]() ×100%=60%。A、反应后剩余固体中镁元素质量分数是
×100%=60%。A、反应后剩余固体中镁元素质量分数是![]() ×100%=52.17%,剩余固体为混合物,故A正确;B、根据质量守恒定律知,原混合物中Mg元素的质量是7.2g,故B正确;C、Mg(OH)2→H2O,混合物中Mg(OH)2 质量应是5.8g,反应生成的氧化镁应是4g,混合物中Mg(OH)2与MgO的质量之比为5.8g∶﹙13.8g -4.0g﹚=29∶49,故C错误;D、根据质量守恒定律知,加热前后的固体分别与相同浓度稀盐酸恰好完全反应所消耗盐酸质量相等,故D正确。
×100%=52.17%,剩余固体为混合物,故A正确;B、根据质量守恒定律知,原混合物中Mg元素的质量是7.2g,故B正确;C、Mg(OH)2→H2O,混合物中Mg(OH)2 质量应是5.8g,反应生成的氧化镁应是4g,混合物中Mg(OH)2与MgO的质量之比为5.8g∶﹙13.8g -4.0g﹚=29∶49,故C错误;D、根据质量守恒定律知,加热前后的固体分别与相同浓度稀盐酸恰好完全反应所消耗盐酸质量相等,故D正确。
点睛∶任何一个化学反应都必然遵循质量守恒定律,根据化学方程式可以计算反应物和生成物的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为探究工业废水的综合利用,某化学小组在实验室中完成了以下实验。
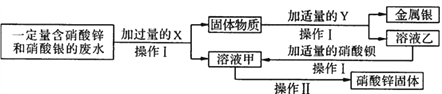
①固体物质的成分有哪些____________?
②写出乙与硝酸钡反应的化学方程式_________________?
③操作I和操作Ⅱ中都要用到一种玻璃仪器。该仪器在操作Ⅱ中的作用是什么______________?
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学实验是进行科学探究的重要方式。
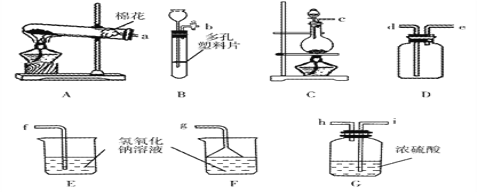
(1)写出一个用A装置制取气体的化学方程式____________________
(2)实验室可用氯化钠固体和浓硫酸在加热条件下反应制取氯化氢气体,该气体极易溶于水,有刺激性气味。若要制取并收集一瓶干燥的氯化氢,并有效防止散失大气中,请选择所需要的装置,装置中导管口连接的顺序为__________。制取氯化氢的化学方程式为_________。
(3)趣味实验:如图,实验时,在水中滴入紫色石蕊溶液,将胶头滴管中水挤入盛有干燥氯化氢气体的烧瓶中,打开橡皮管上的止水夹,可观察到什么现象________?为什么__________?
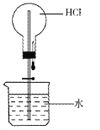
(4)干燥的碳酸钠粉末放入氯化氢的气体中,不反应。但放入盐酸中却能反应。请从微观角度解释不反应的原因________。对于盐酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀盐酸的pH____(填“大于”、“小于”或“等于”)12%的稀盐酸的pH。
(5)取12.5 g石灰石于烧杯中,向其中加入100 g足量的稀盐酸,充分反应后(杂质不参加反应),烧杯中固液混合物的质量为108.1 g,请计算该石灰石中碳酸钙的质量分数___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列指定反应的化学方程式正确的是
A. 《天工开物》烧石灰:CaCO3
 CaO + CO2↑
CaO + CO2↑B. 乙炔的完全燃烧:C2H2 + O2
 H2O + 2CO2
H2O + 2CO2C. 稀硫酸除铁锈:2H2SO4 + Fe2O3 2FeSO4 + 2H2O
D. 铜生锈形成铜绿:2CuO + H2O + CO2 Cu2(OH)2 CO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃
10
20
30
40
50
60
溶解度
S/g
NH4Cl
33.3
37.2
41.4
45.8
50.4
60.2
Na2SO4
9.6
20.2
40.8
48.4
47.5
47.0
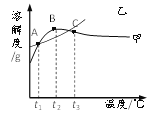
A. 甲为NH4Cl
B. t3℃应介于40℃~50℃
C. 乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D. 甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】烧杯中盛有BaCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是( )

A. ab段产生白色沉淀
B. bc段溶液质量增加86.3g
C. c点对应溶液的溶质质量分数为7.5%
D. 向d点溶液中滴加酚酞试液,溶液显红色
-
科目: 来源: 题型:
查看答案和解析>>【题目】NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如下图所示。下列说法正确的是

A. 储存时发生了化合反应
B. 该技术不能缓解酸雨的形成
C. 该转化中有两种元素化合价发生改变
D. 还原反应:5CO + Ba(NO3)2
 N2 + BaO + 5X,则X的化学式为CO2
N2 + BaO + 5X,则X的化学式为CO2
相关试题

