【题目】烧杯中盛有BaCl2和HCl的混合溶液100.0g,向其中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是( )

A. ab段产生白色沉淀
B. bc段溶液质量增加86.3g
C. c点对应溶液的溶质质量分数为7.5%
D. 向d点溶液中滴加酚酞试液,溶液显红色
参考答案:
【答案】BD
【解析】
碳酸钠首先与盐酸反应生成氯化钠,水和二氧化碳,再与氯化钡反应生成氯化钠和碳酸钡白色沉淀。A、ab段产生氯化钠,水和二氧化碳,故A错误;B、bc段溶液质量增加86.3g,Na2CO3→BaCO3,106→197,﹙212g-106g﹚×10.0%=10.6g,生成碳酸钡质量是19.7g, 溶液质量增加106g-19.7g=86.3g,故B正确;C、Na2CO3→2NaCl→CO2,106→117→44,生成氯化钠质量是11.7g,生成二氧化碳质量是4.4g,BaCl2 +Na2CO3→2NaCl,生成氯化钠质量是112.7g,c点对应溶液的溶质质量分数为![]() ×100%=26.6%,故C错误;D、向d点溶液中滴加酚酞试液,溶液显红色,碳酸钠过量,碳酸钠溶液呈碱性,遇酚酞试液变红,故D正确。
×100%=26.6%,故C错误;D、向d点溶液中滴加酚酞试液,溶液显红色,碳酸钠过量,碳酸钠溶液呈碱性,遇酚酞试液变红,故D正确。
点睛∶充分利用复分解反应的条件,灵活应用质量守恒定律,正确书写化学方程式并根据化学方程式进行简单计算,是顺利完成本题必不可少的条件。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列指定反应的化学方程式正确的是
A. 《天工开物》烧石灰:CaCO3
 CaO + CO2↑
CaO + CO2↑B. 乙炔的完全燃烧:C2H2 + O2
 H2O + 2CO2
H2O + 2CO2C. 稀硫酸除铁锈:2H2SO4 + Fe2O3 2FeSO4 + 2H2O
D. 铜生锈形成铜绿:2CuO + H2O + CO2 Cu2(OH)2 CO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:Mg(OH)2 = MgO+H2O。一定质量的Mg(OH)2和MgO的混合物加热一段时间后,将生成的气体通入到浓硫酸中,增重1.8g,已知剩余固体的质量为13.8g,剩余固体中Mg元素的质量为7.2g,下列说法错误的是
A. 剩余固体为混合物
B. 原混合物中Mg元素的质量为7.2g
C. 混合物中Mg(OH)2与MgO的质量之比为29∶20
D. 加热前后的固体分别与相同浓度稀盐酸恰好完全反应所消耗盐酸质量相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃
10
20
30
40
50
60
溶解度
S/g
NH4Cl
33.3
37.2
41.4
45.8
50.4
60.2
Na2SO4
9.6
20.2
40.8
48.4
47.5
47.0
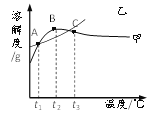
A. 甲为NH4Cl
B. t3℃应介于40℃~50℃
C. 乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D. 甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如下图所示。下列说法正确的是

A. 储存时发生了化合反应
B. 该技术不能缓解酸雨的形成
C. 该转化中有两种元素化合价发生改变
D. 还原反应:5CO + Ba(NO3)2
 N2 + BaO + 5X,则X的化学式为CO2
N2 + BaO + 5X,则X的化学式为CO2 -
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下图回答问题:
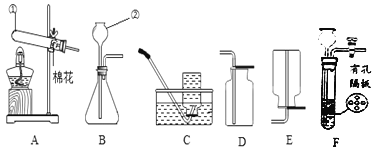
(1)写出有标号的仪器名称:① ,② 。
(2)实验室用高锰酸钾制取O2的化学方程式为 ,用A、D装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是 。
(3)实验室用B、C装置制取CO2的化学方程式为 ,若将发生装置由B改为F,其优点是 。
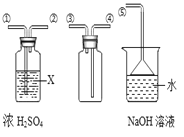
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水。SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气。用下图所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是①→②→ → →⑤(填序号);图中漏斗的作用是 ;烧杯中NaOH溶液的 (用化学方程式表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】钙及其化合物在生产、生活中具有广泛的应用
(一)钙及其化合物的应用
(1)青少年缺“钙”易患的疾病是________。
(2)混凝土中也含有一定量的含钙物质,钢筋与混凝土混合形成钢筋混凝土,以上叙述中不涉及的材料是_________。 a.无机材料 b.合成材料 c.复合材料
(3)即热型快餐加热原理是利用生石灰和水反应放热,用方程式表示其反应__________。
(二)过氧化钙(CaO2)的性质
(1)CaO2中氧元素的化合价为_____________。
(2)CaO2能与稀盐酸发生复分解反应,反应的化学方程式为_____________。
(3)鱼类长途运输的增氧剂的主要成分为CaO2,它与水缓慢反应生成O2,还生成一种碱,其化学式为_______,Na2O2也能与水反应,原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析可能的原因___________________。
(三)过氧化钙晶体的制备
(资料)过氧化钙晶体(CaO2·yH2O),常温为白色,能溶于酸,难溶于酒精。
制备原理:CaCl2+H2O2+NH3+H2O
 CaO2·yH2O↓+NH4Cl,装置如下。
CaO2·yH2O↓+NH4Cl,装置如下。
(1)装置A中试管内发生反应的化学方程式为______________________。
(2)装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·yH2O产率;
Ⅱ. _____________________________。
(3)反应结束后,经过滤、洗涤、低温烘干可获得CaO2·yH2O。
①洗涤时采用95%的酒精溶液洗涤的优点是_________________。
②检验晶体已洗涤干净的方法为________________________。
(四)过氧化钙晶体组成的测定
称取21.6克晶体用热分析仪对其进行热分解实验,并绘制成固体质量与温度关系图(过氧化钙晶体受热时会先失去结晶水)

(1)0—150℃质量不发生改变的原因是______________________。
(2)根据上图可知y=________。
(3)350℃时发生反应的化学方程式为_____。
相关试题

