【题目】某化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应) 中碳酸钙的质量分数,进行如图所示的实验。请根据以上信息回答下列问题:
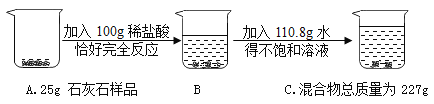
(1) 写出反应的化学方程式____________;
(2) 列出求解该样品中参加反应的碳酸钙质量(x) 的比例式____________;
(3) 生成的氯化钙的质量为____________;
(4) 该样品中碳酸钙的质量分数为____________;
(5) 用这种石灰石125t 制取含杂质的生石灰的质量为____________。
参考答案:
【答案】 CaCO3+2HCl=CaCl2+CO2↑+H2O ![]() 22.2g 80% 56t
22.2g 80% 56t
【解析】(1)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)二氧化碳的质量为25g+100g+110.8g-227g=8.8g;设样品中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 8.8g
![]()
x=20g;
故填: ![]() ;
;
(3)设生成氯化钙质量为y,
CaCO3+2HCl=CaCl2+CO2↑+H2O
111 44
y 8.8g
![]()
y=22.2g。
(4)该样品中碳酸钙的质量分数=![]() ×100%=80%;
×100%=80%;
(5)设生成生石灰的质量为z,
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 56
125t ×80% z
![]()
z=56t,
答:用这种石灰石125t 制取含杂质的生石灰的质量为56t。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的用途主要利用其化学性质的是( )
A.可燃冰用作燃料 B.“干冰”用于人工降雨
C.生铁铸造铁锅 D.铜用于制造导线
-
科目: 来源: 题型:
查看答案和解析>>【题目】中学实验室现有氯酸钾、二氧化锰、稀硫酸、紫色石蕊溶液、石灰石和稀盐酸,以及下列仪器:
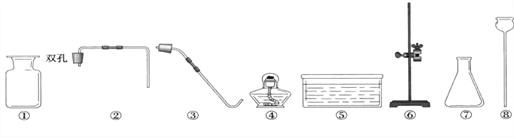
(1) 利用上述仪器和药品可制取二氧化碳,你选择的仪器是____________(填序号),若补充一种仪器____________(填仪器名称),再利用上述仪器和药品还可以制取氧气的化学方程式为____________。
(2) 制取氧气时需先检查装置的气密性: 连接好仪器。将导管一端浸入水中,用手紧握容器外壁,使容器内温度____________,压强变____________,观察到水中导管口有气泡冒出时,说明装置不漏气。
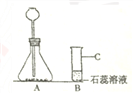
(3) 利用上述仪器制备并检验二氧化碳的性质,B中的实验现象为____________,请帮将实验装置图补充完整___________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年“六·五”世界环境日中国主题是“污染减排与环境友好型社会”。推动污染减排、建设环境友好型社会是全社会共同的责任。下列物质中属于大气主要污染物,必须减少排放的是( )
A. 二氧化硫(SO2) B. 二氧化碳(CO2) C. 氮气(N2) D. 氧气(O2)
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E、F为八年化学学习过的六种物质。其中A.B.D通常状态下为气体,B.C.D 均为氧化物,E、F 含有相同原子团。这六种物质之间的反应关系如图所示,其中“一”表示相连的两种物质能够发生化学反应,“→”表示一种物质经过一步转化可以生成另一种物质(有些反应关系已略去,反应条件已略去)。请回答问题:
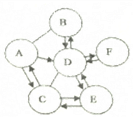
(1) 写出下列物质的化学式: D____________、F____________;
(2) 写出D转化为F 的化学方程式____________。
(3) A与B反应的实验现象:____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图1所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压).下列说法正确的是

A. 燃烧匙内所装红磷或木炭的多少对实验结果无影响
B. 反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的
C. p=0.79p0,p′=p0是因为红磷的着火点比木炭低
D. 由图3可推出空气中氧气的含量
-
科目: 来源: 题型:
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系是化学学科的特点.
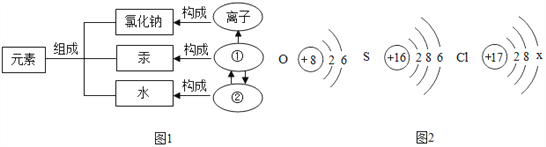
(1)物质的组成及构成关系如图1所示,图中 ①表示的是_____,②表示的是_____.
(2)下列说法正确的是_____(填字母).
A.氯化氢是由氢、氯两种元素组成的
B.氯化氢是由氢气和氯气混合而成的
C.氯化氢是由一个氢原子和一个氯原子构成的
(3)如图2所示是氧、硫、氯三种元素的原子结构示意图.
①氯原子的结构示意图中x的数值是_____.
②氧和硫两种元素的化学性质具有相似性的原因是它们原子的_____相同.
将下列物质按要求分类(用序号填写):
①氧气 ②冰水混合物 ③氯酸钾 ④纯牛奶 ⑤铁粉
(1)属于混合物的是____________;(2)属于化合物的是_____________;
(3)属于氧化物的是____________;(4)属于单质的是______________。
相关试题

