【题目】某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验。取12.5g的石灰石样品研碎和100g溶质质量分数为10%的稀盐酸放入烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(假设杂质不溶于水,也不与稀盐酸反应。),最终烧杯内物质的质量为108.1g。请计算:
(1)生成二氧化碳气体的质量是多少;
(2)反应后溶液中溶质的质量分数。(计算结果精确至0.1 % )
参考答案:
【答案】(1)4.4 (2)10.5%
【解析】(1)反应前烧杯中物质的总质量为12.5g+100g=112.5g,
反应后烧杯内物质的质量变为108.1g,
由质量守恒可知,二氧化碳的质量为112.5g-108.1g=4.4g,
(2)设碳酸钙的质量为x,生成的氯化钙的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 111 44
x y 4.4g
![]()
解得x=10g,y=11.1g,
因杂质既不溶于水,也不与其他物质反应,
则溶液的质量为108.1g-(12.5g-10g)=106g,
溶质的质量为11.1g,
则溶质的质量分数为![]() ×100%=10.5%,
×100%=10.5%,
答:反应后所得溶液中溶质的质量分数为10.5%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】减少污染,净化空气。下列气体会造成空气污染的是
A.一氧化碳 B.二氧化碳 C.氧气 D.氮气
-
科目: 来源: 题型:
查看答案和解析>>【题目】请你根据所学知识并结合下图所示装置回答有关问题:
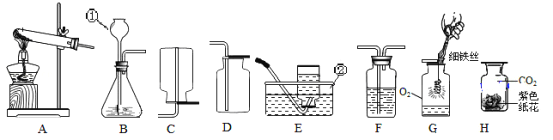
(1)指出标号仪器的名称:①______________;②____________。
(2)用高锰酸钾制取氧气的化学方程式为_______________,可以用E装置收集氧气当观察到______________________现象时,说明氧气已收满。
(3)制取并收集一定量的二氧化碳,应选择的发生装置是_______,欲制得干燥的二氧化碳,还需将气体通过盛有_______________(填药品名称)的洗气瓶F。
(4)用收集到的氧气和二氧化碳分别完成如图G、H所示实验,G中集气瓶底部盛有少量水的原因是______________,H中喷有紫色石蕊溶液的纸花显________色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】构成物质的粒子有分子、原子和离子,有关这三种粒子的说法错误的是
A. 分子和原子都在不断运动,而离子是静止的
B. 同种原子可能构成不同种分子
C. 同一元素的两种粒子,其原子核内质子数一定相同
D. 当原子失去或者得到电子后,其性质发生了改变
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化硫是造成酸雨的主要成分之一,二氧化硫排放到空气中溶于水生成亚硫酸(H2SO3),其中亚硫酸中硫元素(S)的化合价为
A. +2 B. -2 C. +4 D. +6
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是
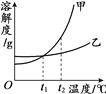
A. 依据溶解度曲线可判断,甲的溶解度比乙的大
B. 将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大
C. t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等
D. 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是重要资源。
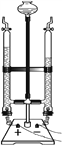
(1)在自来水厂取水口管道入口处设有拦污栅,此处相当于实验基本操作中的_______________。
(2)电解水实验如图所示,与负极相连的玻璃管中产生的气体是_____,该反应的化学方程式为_________________________________。
(3)利用如图所示的简易装置可把海水转化为淡水。
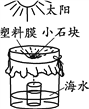
下列说法正确的是____________。
A.小容器中的水为淡水
B.获得淡水的速度与温度有关
C.大容器中的溶液一定是氯化钠的饱和溶液
相关试题

