【题目】下图表示某些物质间转化关系。已知D是一种最常见液体,C为紫红色金属,E为黑色固体。A、B、M、F为气体,F能参与绿色植物的光合作用。请回答:
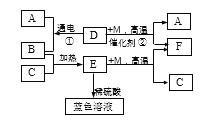
(1)E的化学式______;
(2)蓝色溶液中一定含有的溶质是______________(写化学式);
(3)写出下列反应的化学方程式:①__________;②__________;实验室进行反应①时,常加入少量稀硫酸,其目的是__________。
(4)工业上可用A和F合成乙醇(C2H6O),反应中A和F的质量比为__________。
参考答案:
【答案】 CuO CuSO4 2H2O ![]() 2H2+O2↑ CO+H2O
2H2+O2↑ CO+H2O ![]() CO2+H2 增强导电性 3∶22
CO2+H2 增强导电性 3∶22
【解析】最常见液体是水,故D是H2O,C为紫红色金属,则C是Cu,Cu在加热时能与氧气反应生成黑色的氧化铁,E为黑色固体,故E是CuO,B是O2,H2O在通电条件下,发生分解反应生成氧气和氢气,故A是H2。F为气体,能参与绿色植物的光合作用,则F是CO2。(1)E的化学式CuO。(2) CuO + H2SO4 ==CuSO4 + H2O,CuSO4易溶于水,形成的溶液为蓝色,故蓝色溶液中一定含有的溶质是CuSO4。(3)反应①的化学方程式:2H2O![]() 2H2↑+ O2↑,反应②的化学方程式为:CO+H2O
2H2↑+ O2↑,反应②的化学方程式为:CO+H2O ![]() CO2+H2。纯净的水几乎不导电,为了增强水的导电性,向水中加入少量稀硫酸。(4)工业上合成乙醇的化学方程式为:6H2 + 2CO2== C2H6O + 3H2O,反应中H2和CO2的质量比为:(6×2):(2×44)=3:22。
CO2+H2。纯净的水几乎不导电,为了增强水的导电性,向水中加入少量稀硫酸。(4)工业上合成乙醇的化学方程式为:6H2 + 2CO2== C2H6O + 3H2O,反应中H2和CO2的质量比为:(6×2):(2×44)=3:22。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅(Si)是半导体材料,利用石英砂(主要成分是 SiO2)制取高纯度 Si,其流程图如图:
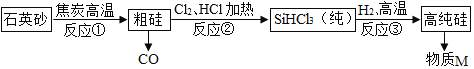
下列说法正确的是( )
A. 反应①、③为置换反应
B. 反应①产生的尾气可直接排放
C. 该过程中各元素的化合价均发生了变化
D. 反应③为 SiHCl3+H2
 Si+3M,M 可循环使用
Si+3M,M 可循环使用 -
科目: 来源: 题型:
查看答案和解析>>【题目】有Mg、Fe、Cu的混合粉末,分离并得到MgSO4·7H2O过程如下:
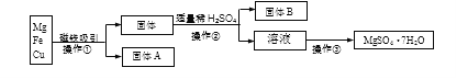
(1)固体A是____________________。
(2)操作②中用到的主要玻璃仪器有________________、玻璃棒和烧杯等。
(3)操作③主要包含蒸发浓缩、______________、过滤、洗涤烘干等。
(4)实验中可选用适量的下列试剂中的________________代替稀H2SO4(填标号)。
a.CuSO4溶液 b.FeSO4溶液 c.稀盐酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上生产电石(CaC2)并制备重要工业原料乙炔(CxHy)流程如图1所示:
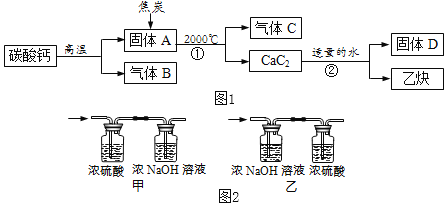
【资料】
①碳酸钙高温分解可得两种氧化物。
②浓硫酸具有强吸水性,NaOH溶液能吸收CO2。
【讨论】
(1)C、B组成元素相同,C有毒,反应①化学方程式为_____。
(2)D微溶于水,溶解度随温度升高而减小,D的化学式是_____。
【测定乙炔组成】
资料:一个乙炔分子有四个原子构成。
(3)将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过如图2所示的_____(选填“甲”或“乙”)装置,并再缓缓通一段时间的N2,并记录实验数据于如表中。
装置
反应前质量
反应后质量
浓硫酸
125.3g
127.1g
浓NaOH溶液
78.2g
87.0g
(4)实验中“缓缓通一段时间的N2”的目的是_____。
(5)计算:乙炔中碳元素质量为_____g,氢元素质量为_____g,乙炔化学式为_____。
(6)反应②的化学方程式为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】MgSO4和Na2CO3的溶解度表及溶解度曲线如下。下列说法错误的是
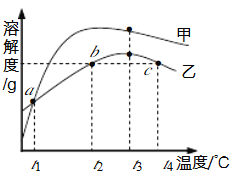
温度/℃
20
30
40
50
60
70
80
溶解度
S/g
MgSO4
25.1
28.2
30..8
32.9
34.3
35.0
34.9
Na2CO3
21.5
39.7
49.0
48.5
46.0
45.2
43.9
A. 甲为Na2CO3
B. 乙的饱和溶液从t1升温到t4,溶质质量分数增大
C. 等质量甲、乙饱和溶液从t3降温到t1,析出晶体的质量(不带结晶水):乙>甲
D. b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
-
科目: 来源: 题型:
查看答案和解析>>【题目】(一)铁的应用和防护
【1】我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______________。
【2】铁生锈的主要过程为
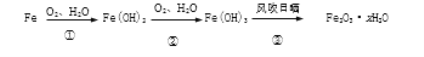
(1)写出转化①的化学方程式________________________
(2)转化③生成Fe2O3·xH2O,则x≤____________(x为整数)。
【3】请提出防止铁生锈的一条措施________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(二)铁的化合物应用
黄铁矿(主要成分是FeS2),是一种重要的化工原料,可用来制备硫酸和炼铁。
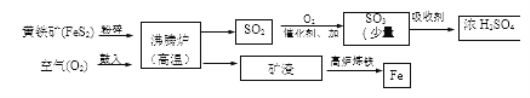
【1】工业上将黄铁矿粉碎的目的是____________________。
【2】生产硫酸后的尾气中含有SO2,如直接排放可能会造成环境问题是__________________。
【3】高炉炼铁的化学方程式为__________________________。
【4】150吨含FeS2 80%的黄铁矿理论上最多可以制得98%的浓硫酸________________吨。
相关试题

