【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
Ⅰ.(镍粉制备)
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O],并利用其制备镍粉的流程如下:
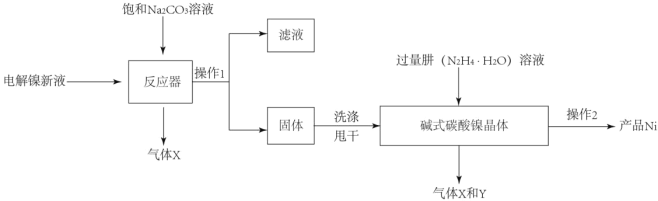
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_____。
(2)物料在反应器中反应时需要控制反应条件。
分析下图,反应器中最适合的温度及pH分别为_____℃、_____。
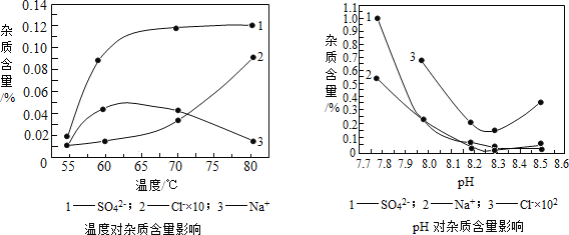
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将_____(填“升高”、“降低”或“不变”)。
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是_____。
Ⅱ.(测定碱式碳酸镍晶体的组成)
为测定碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]组成,某小组设计了如下实验方案及装置:
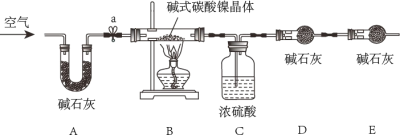
(资料卡片)
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
②碱石灰是NaOH和CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称量3.77g碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;
④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
(实验分析及数据处理)
(1)实验过程中步骤⑤鼓入空气的目的是_____。
(2)计算3.77g碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]中镍元素的质量_____。最终通过计算得到了碱式碳酸镍晶体的组成。
(实验反思)
(3)另一小组同学加热时在酒精灯上加了铁丝网罩,实验结束后,称得装置B中残留固体质量明显增大。经查阅资料发现:在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3。该组同学称得残留的固体中镍元素的质量分数可能是_____。
A 70.1% B 75.9% C 78.7% D 79.6%
参考答案:
【答案】CO2 55 8.3 升高 使固体能快速晾干 将生成物带入吸收装置中,使生成物能够被完全吸收,防止生成物残留带来计算误差 1.77g B
【解析】
Ⅰ.[镍粉制备](1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO32Ni(OH)2+3Na2SO4+2X,反应前Ni原子共3个、S原子共3个、O原子共23个、Na原子6个、C原子3个、H原子4个,反应后现有:Ni原子3个、S原子共3个、O原子共19个、Na原子6个、C原子1个、H原子4个,少O原子4个,C原子2个,而这些微粒包含在2个X分子中,所以X的化学式为CO2;
(2)根据给出的温度和pH对杂质含量的影响图可知,要想杂质含量最低,则需要控制反应器中最适合的温度及pH分别为55℃、8.3;
(3)由于NiCO3中含镍量比Ni(OH)2中低,生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,而Ni(OH)2中含镍量高,所以会造成生成的碱式碳酸镍晶体中,镍的含量将升高;
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,由于酒精易挥发,所以用95%酒精浸泡的目的是便于快速晾干;
Ⅱ.[测定碱式碳酸镍晶体的组成](1)实验过程中步骤⑤鼓入空气的目的是为了将生成物带入吸收装置中,使生成物能够被完全吸收,防止生成物残留带来计算误差;
(2)反应生成水的质量为:251.08g-250.00g=1.08g,反应生成二氧化碳质量为:190.44g-190.00g=0.44g,反应生成NiO质量为:3.77g-1.08g-0.44g=2.25g,3.77g碱式碳酸镍晶体[xNiCO3yNi(OH)2zH2O]中镍元素的质量为:2.25g×59÷75×100%=1.77g;
(3)如果固体全部是Ni2O3,Ni2O3中镍元素质量分数为:![]() ×100%=71.08%,NiO中镍元素质量分数为:
×100%=71.08%,NiO中镍元素质量分数为:![]() ×100%=78.67%,该组同学称得的残留固体中镍元素的质量分数应该是大于71.08%,小于78.67%,因此该组同学称得的残留固体中镍元素的质量分数可能是B。
×100%=78.67%,该组同学称得的残留固体中镍元素的质量分数应该是大于71.08%,小于78.67%,因此该组同学称得的残留固体中镍元素的质量分数可能是B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2019年1月,被称为“第一部中国自己的科幻大片”《流浪地球》受到极大关注。
(1)影片中幻想了因太阳氦闪,地球将被摧毁。氦气属于_____(填“单质”或“化合物”),你的判断依据是_____。
(2)影片中幻想了将木星上氢气点燃,达到使地球脱离木星控制的目的。氢气燃烧的化学方程式是_____。
(3)氢能是清洁能源之一,而石油是化石燃料之一。下列属于石油综合利用产品的是_____。
A 液化石油气 B.汽油 C 柴油 D 煤油
(4)偏二甲肼是一种运载火箭的推进燃料,其相对分子质量为60。取一定量偏二甲肼在氧气中完全燃烧,反应前后各物质的质量如下图所示,偏二甲肼在氧气中完全燃烧的化学方程式是_____。
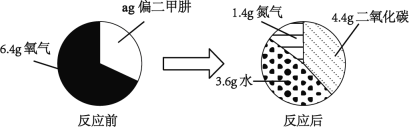
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命之源,水和溶液在化学实验中的作用也不可忽视。用你学过的化学知识回答下列问题。
(1)秦淮河是南京的母亲河,为了检验秦淮河水是硬水还是软水,可向水中加_____。
(2)水是常见的溶剂,固体X和Y在水中的溶解度曲线如图甲所示。
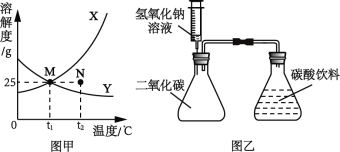
①N点表示t2℃时X的_____(填“饱和溶液”或“不饱和溶液”)。
②t1℃时,X的饱和溶液中溶质的质量分数为_____。
③将接近饱和的Y溶液变为饱和溶液,下列说法正确的是_____。
A 溶质的质量一定不变 B 溶剂的质量可能变小 C 溶液的质量可能变大 D 溶质的质量分数一定变大
(3)按图乙所示装置,锥形瓶B内是碳酸饮料,将氢氧化钠溶液通过注射器加入到充满二氧化碳的锥形瓶A内,可观察到B中气泡明显增多,其原因是_____。
(4)配制100g质量分数为6%的氯化钠溶液时,以下操作会导致所得溶液的溶质质量分数偏小的是_____
A 用托盘天平称量6.0g粗盐,放入烧杯中
B 用量筒量取94mL水时仰视读数,并将水全部倒入上述烧杯中
C 将配制好的氯化钠溶液装入试剂瓶中,有部分溶液洒出
D 盛配制好的氯化钠溶液的试剂瓶没有干燥,残留少量蒸馏水
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A-J是初中化学常见物质,且分别由H、O、Al、S、Cl、Fe、Cu中的一种或几种元素组成。A、D、E、G、I均为单质,A在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能,E为紫红色固体;J为金属氧化物;B、C均由三种元素组成。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应物条件已略去。
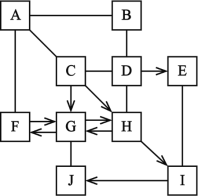
(1)写出E的化学式:_____
(2)写出A与B反应的化学方程式_____
(3)E和I反应的基本反应类型为_____
(4)写出G→F反应的化学方程式_____
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取某些气体的装置如图,回答有关问题。

(1)若选用装置A和F组合制取氧气,其化学方程式可以为_____,选用F装置收集氧气的原因是_____。
(2)若选用装置B作为制取二氧化碳的发生装置,其中试管的作用是_____。(填1种即可)
(3)若选用装置C作为制取氢气的发生装置,添加稀硫酸时,液面最好添加到如图_____处(填字母“a”、“b”或“c”)。
(4)实验室用73g质量分数为10%的盐酸与足量大理石反应,最多能生成二氧化碳的质量是多少?_____
-
科目: 来源: 题型:
查看答案和解析>>【题目】运用图示法可以帮助我们巧学化学,下列化学知识用相应图示表示正确的是( )
A.
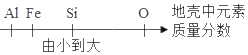
B.
C.
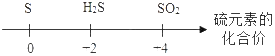
D.

-
科目: 来源: 题型:
查看答案和解析>>【题目】如图表示治理汽车尾气所涉及反应的微观过程.下列说法不正确的是( )
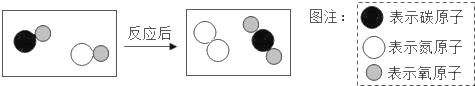
A. 图中单质的化学式为N2
B. 该反应使有毒气体转化为无毒气体
C. 生成单质与化合物的质量比为7:22
D. 该反应中生成物的分子个数比为1:1
相关试题

