【题目】水是生命之源,水和溶液在化学实验中的作用也不可忽视。用你学过的化学知识回答下列问题。
(1)秦淮河是南京的母亲河,为了检验秦淮河水是硬水还是软水,可向水中加_____。
(2)水是常见的溶剂,固体X和Y在水中的溶解度曲线如图甲所示。
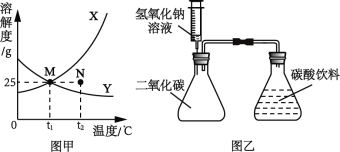
①N点表示t2℃时X的_____(填“饱和溶液”或“不饱和溶液”)。
②t1℃时,X的饱和溶液中溶质的质量分数为_____。
③将接近饱和的Y溶液变为饱和溶液,下列说法正确的是_____。
A 溶质的质量一定不变 B 溶剂的质量可能变小 C 溶液的质量可能变大 D 溶质的质量分数一定变大
(3)按图乙所示装置,锥形瓶B内是碳酸饮料,将氢氧化钠溶液通过注射器加入到充满二氧化碳的锥形瓶A内,可观察到B中气泡明显增多,其原因是_____。
(4)配制100g质量分数为6%的氯化钠溶液时,以下操作会导致所得溶液的溶质质量分数偏小的是_____
A 用托盘天平称量6.0g粗盐,放入烧杯中
B 用量筒量取94mL水时仰视读数,并将水全部倒入上述烧杯中
C 将配制好的氯化钠溶液装入试剂瓶中,有部分溶液洒出
D 盛配制好的氯化钠溶液的试剂瓶没有干燥,残留少量蒸馏水
参考答案:
【答案】肥皂水 不饱和溶液 20% BC A 瓶中 NaOH 溶液吸收 CO2,使得 A 中气压变小,引起B 中气压变小,压强变小,气体的溶解度减小,所以碳酸饮料中的 CO2 从饮料中逸出 ABD
【解析】
(1)肥皂水,在硬水中产生的泡沫较少,在软水中的泡沫较多,所以为了检验秦淮河水是硬水还是软水,可向水中加肥皂水;
(2)①N点在X物质溶解度曲线的下方,所以表示t2℃时X的不饱和溶液;
②t1℃时,X物质的溶解度是25g,所以X的饱和溶液中溶质的质量分数为![]() ×100%=20%;
×100%=20%;
③将接近饱和的Y溶液变为饱和溶液,A、增加溶质的方法,溶质的质量一定变大,故错误;
B、蒸发溶剂的方法,溶剂的质量可能变小,故正确;
C、增加溶质的方法,溶液的质量可能变大,故正确
D、升高温度的方法,溶质的质量分数不变,故错误;
(3)按图乙所示装置,锥形瓶B内是碳酸饮料,将氢氧化钠溶液通过注射器加入到充满二氧化碳的锥形瓶A内,可观察到B中气泡明显增多,原因是:A瓶中NaOH溶液吸收二氧化碳,使得A中气压变小,引起B中气压变小,压强变小,气体的溶解度减小,所以碳酸饮料中的二氧化碳从饮料中逸出;
(4)A、用托盘天平称量6.0g粗盐,放入烧杯中,溶质质量偏小,会导致所得溶液的溶质质量分数偏小,故正确;
B、用量筒量取94mL水时仰视读数,并将水全部倒入上述烧杯中,水的体积偏大,会导致所得溶液的溶质质量分数偏小,故正确;
C、将配制好的氯化钠溶液装入试剂瓶中,有部分溶液洒出,不会影响溶质的质量分数,故错误;
D、盛配制好的氯化钠溶液的试剂瓶没有干燥,残留少量蒸馏水,水的实际体积偏大,会导致所得溶液的溶质质量分数偏小,故正确。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③双手紧贴并倒转瓶口。三步实验中测得氧气的体积分数随时间变化的曲线依次为下图中的 MN 段、NP 段和PR 段。下列说法不正确的是( )
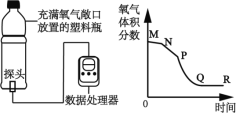
A. 曲线中 M→N 的变化过程,说明氧分子是不断运动的
B. 曲线中 M→N 和N→P 相比较,说明温度越高分子运动速度越快
C. 曲线中N→P 和P→Q 相比较,说明氧气密度比空气密度大
D. 曲线中P→Q 和Q→R 相比较,说明Q 点后氧分子的运动速度减慢
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素周期律的发现,使化学学习和研究变得有规律可循,下表列出的是1-18号元素的部分最高正化合价和最低负化合价,阅读并回答下列问题:
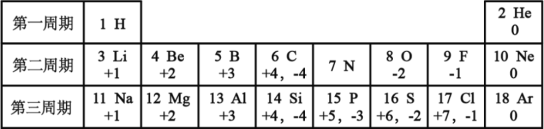
(1)12号元素属于_____(填“金属”或“非金属”)元素,它在化学反应中形成的离子与_____(填元素名称)原子具有相同的核外电子排布。
(2)氮元素的原子核外电子数为_____,其最低负化合价与氢形成的化合物的化学式为_____,该物质溶于水后形成的溶液显_____(填“酸性”、“碱性”或“中性”);某化合物中同时含有氮元素的最高正化合价和最低负化合价,写出该化合物的化学式并标出氮元素的化合价_____。
(3)第三周期元素化合价变化的趋势是_____。
(4)碳元素形成的物质种类很多,其中C和CO是初中化学常见的还原剂,当它们作还原剂时,碳元素的化合价均_____(填“上升”、“下降”或“不变”)。请判断反应NaH+H2O=NaOH+H2↑中,作还原剂的是_____(填化学式)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2019年1月,被称为“第一部中国自己的科幻大片”《流浪地球》受到极大关注。
(1)影片中幻想了因太阳氦闪,地球将被摧毁。氦气属于_____(填“单质”或“化合物”),你的判断依据是_____。
(2)影片中幻想了将木星上氢气点燃,达到使地球脱离木星控制的目的。氢气燃烧的化学方程式是_____。
(3)氢能是清洁能源之一,而石油是化石燃料之一。下列属于石油综合利用产品的是_____。
A 液化石油气 B.汽油 C 柴油 D 煤油
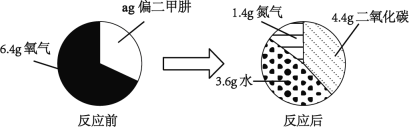
(4)偏二甲肼是一种运载火箭的推进燃料,其相对分子质量为60。取一定量偏二甲肼在氧气中完全燃烧,反应前后各物质的质量如下图所示,偏二甲肼在氧气中完全燃烧的化学方程式是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A-J是初中化学常见物质,且分别由H、O、Al、S、Cl、Fe、Cu中的一种或几种元素组成。A、D、E、G、I均为单质,A在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能,E为紫红色固体;J为金属氧化物;B、C均由三种元素组成。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应物条件已略去。
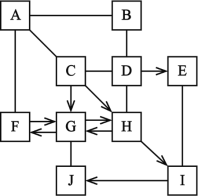
(1)写出E的化学式:_____
(2)写出A与B反应的化学方程式_____
(3)E和I反应的基本反应类型为_____
(4)写出G→F反应的化学方程式_____
-
科目: 来源: 题型:
查看答案和解析>>【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
Ⅰ.(镍粉制备)
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O],并利用其制备镍粉的流程如下:
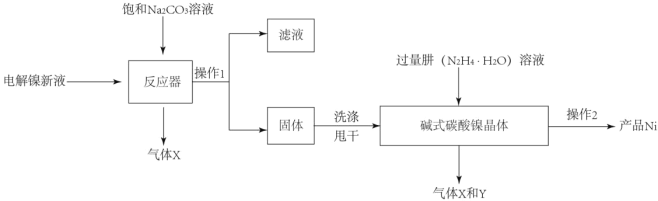
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_____。
(2)物料在反应器中反应时需要控制反应条件。
分析下图,反应器中最适合的温度及pH分别为_____℃、_____。
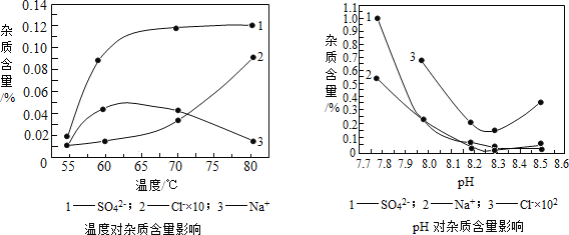
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将_____(填“升高”、“降低”或“不变”)。
(4)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是_____。
Ⅱ.(测定碱式碳酸镍晶体的组成)
为测定碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]组成,某小组设计了如下实验方案及装置:
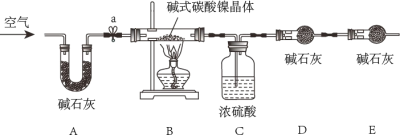
(资料卡片)
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
②碱石灰是NaOH和CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称量3.77g碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;
④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)
装置C/g
装置D/g
装置E/g
加热前
250.00
190.00
190.00
加热后
251.08
190.44
190.00
(实验分析及数据处理)
(1)实验过程中步骤⑤鼓入空气的目的是_____。
(2)计算3.77g碱式碳酸镍晶体[xNiCO3●yNi(OH)2●ZH2O]中镍元素的质量_____。最终通过计算得到了碱式碳酸镍晶体的组成。
(实验反思)
(3)另一小组同学加热时在酒精灯上加了铁丝网罩,实验结束后,称得装置B中残留固体质量明显增大。经查阅资料发现:在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3。该组同学称得残留的固体中镍元素的质量分数可能是_____。
A 70.1% B 75.9% C 78.7% D 79.6%
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取某些气体的装置如图,回答有关问题。

(1)若选用装置A和F组合制取氧气,其化学方程式可以为_____,选用F装置收集氧气的原因是_____。
(2)若选用装置B作为制取二氧化碳的发生装置,其中试管的作用是_____。(填1种即可)
(3)若选用装置C作为制取氢气的发生装置,添加稀硫酸时,液面最好添加到如图_____处(填字母“a”、“b”或“c”)。
(4)实验室用73g质量分数为10%的盐酸与足量大理石反应,最多能生成二氧化碳的质量是多少?_____
相关试题

