【题目】为测定某氮肥中硫酸铵的纯度(即质量分数)是否与如图标签相符,小林取一定量该氮肥样品与烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如表。

反应前 | 反应后 | |
烧杯和样品溶液总质量 | 氯化钡溶液质量 | 过滤后烧杯和溶液总质量(滤液的损失忽略不计) |
45g | 55g | 76.7g |
反应的化学方程式为(NH4)2SO4+BaCl2═BaSO4↓+2NH4Cl,其他成分能溶于水但不参加反应。
(1)反应共生成BaSO4的质量为 g。
(2)若所取氮肥样品的质量为15g,试通过计算确定氮肥中硫酸铵的纯度是否与标签相符。(请写出计算过程)
(3)反应前后,溶液中硫元素的质量 (填“不变”、“增大”或“减小”)。其原因是 。
参考答案:
【答案】(1)23.3;(2)不符合标准;(3)减小;反应后,硫酸根转化到硫酸钡中沉淀下来,故溶液中硫元素的质量减小
【解析】(1)反应前后的差量是生成沉淀的质量:45g+55g-76.7g=23.3g
(2)设15g样品中(NH4)2SO4的质量为x,
(NH4)2SO4+BaCl2==BaSO4↓+2NH4Cl
132 233
x 23.3g
![]() =
=![]() 解得x= 13.2g
解得x= 13.2g
氮肥中硫酸铵的纯度为: ![]() ×100%=88%
×100%=88%
88%<96%, 故氮肥中硫酸铵的纯度与标签不相符。
(3)反应后溶液中硫元素的质量减小,原因是反应后,硫酸根转化到硫酸钡中沉淀下来,故溶液中硫元素的质量减小。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关实验现象的描述,正确的是
A.铁丝在氧气中剧烈燃烧,火星四射,生成白色固体
B.分别点燃一小块棉纤维和羊毛纤维,都产生烧焦羽毛的气味
C.测定空气中氧气含量的实验里,铜丝加热变黑
D.一氧化碳高温还原氧化铁时,红色粉末逐渐变为银白色
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过分析下列实验或现象,可以得出相应的结论,其中不合理的是( )
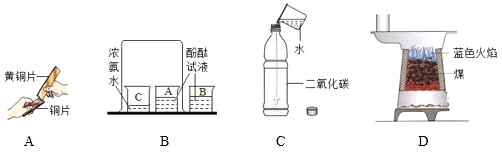
A. 实验中黄铜片能在铜片上刻画出痕迹,说明黄铜的硬度比铜片大
B. 实验既可以说明分子在不停地运动着,又可以说明氨水显碱性
C. 实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性
D. 图中煤炉里煤炭上方燃烧产生的蓝色火焰说明一氧化碳具有可燃性
-
科目: 来源: 题型:
查看答案和解析>>【题目】屠呦呦曾从西晋医学家葛洪的《肘后备急方》中获得灵感,她因此认识到不能用加热法提取青蒿素;于是改用低沸点的乙醚提取,终于在经历第190次失败后获得成功,并荣获2015年诺贝尔生理学或医学奖。请回答:
(1)研究表明,在60 ℃时青蒿素的结构就会被破坏,从而失去疗效。据此可知,青蒿素具有的化学性质是 ;青蒿素药品应密封保存在 处。
(2)乙醚的分子结构如下图所示,其中短线表示原子间的连接,则乙醚的化学式为 ,乙醚中氧元素的质量分数是 (精确到0.1%)。
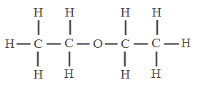
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)某校化学兴趣小组在制取完二氧化碳实验后对固液残留物进行回收处理。
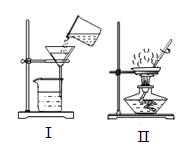
①对固液残留物进行过滤,应选择图中_______(填标号)装置,该装置缺少的仪器是_______;
②取上述少量滤液进行蒸发,蒸发时玻璃棒不断搅拌的目的是_________________,析出的固体中一定含有的物质是__________(写名称)。
(2)某校化学兴趣小组用图1装置探究铁生锈的条件。
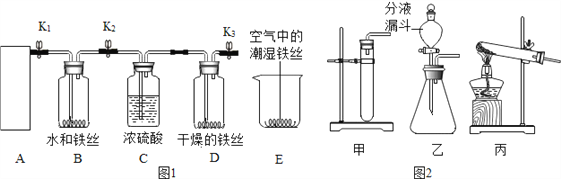
Ⅰ气体发生装置的选择
A装置用双氧水和二氧化锰制取氧气,为了控制反应速率,得到平稳的氧气流,应选择图2中的_______(填“甲”、“乙”或“丙”)装置,该反应的化学方程式为___________。
Ⅱ铁生锈条件的探究
①图1C装置中浓硫酸的作用是__________。
②打开K1、K2、K3,通入氧气,检验氧气已充满整个装置的方法是___________。关闭K1、K2、K3,2天后观察到:B处铁丝表面布满铁锈,D处铁丝依然光亮,E中铁丝表面有部分铁锈。
实验结论:铁生锈主要是铁与_______和_______发生反应。
③B、E处实验现象对比说明:影响铁生锈快慢的一种因素是___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】白云岩矿(含CaO、MgO)常用于生产K2SO4肥及氮钾复合肥。

(1)将白云岩矿石粉碎的目的___________________________;
(2)操作a是_______,用到的玻璃仪器除玻璃棒还有_______,玻璃棒作用________;
(3)反应②化学方程式为CaSO4·2H2O + 2 NH4HCO3 == CaCO3↓ + (NH4)2SO4 + CO2↑+ 3H2O,该反应温度需控制在60℃左右,原因________________________;
(4)K2SO4在水中溶解度小于(NH4)2SO4,写出反应③的化学方程式________,操作b的步骤:________、冷却结晶、过滤而得到氮钾复合肥。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于“燃烧和灭火”的叙述正确的是
A. 档案室着火用泡沫灭火器灭火
B. 炒菜时油锅着火,立即盖上锅盖
C. 只有含碳元素的物质才能燃烧
D. 只要温度达到可燃物的着火点,可燃物就能燃烧
相关试题

