【题目】阳光中学化学兴趣小组的同学为测定某纯碱(Na2CO3)样品中(只含有少量的氯化钠杂质)碳酸钠的质量分数,现称取12.0g样品放入烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为44.1g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示。试计算:
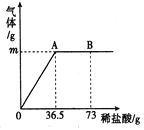
(1)A点产生气体的质量为_________;
(2)该样品中碳酸钠的质量分数?(精确到0.1%,下同)__________
(3)B点时,烧杯内溶液中溶质的化学式___________。
(4)B点溶液中溶质NaCl的质量分数____________?
参考答案:
【答案】 4.4g 88.3% 氯化钠(NaCl)和加入稀盐酸(HCl) 16.3%
【解析】(1)根据质量守恒定律,A点产生气体的质量为12.0g+36.5g-44.1g=4.4g。(2)解∶设该样品中碳酸钠的质量分数为x,生成氯化钠质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
12.0g×x y 4.4g
![]() =
=![]() , x=88.3%。
, x=88.3%。
![]() =
=![]() ,y=11.7g。
,y=11.7g。
(3)碳酸钠与盐酸反应生成氯化钠,B点时,盐酸已过量,烧杯内溶液中溶质的化学式是NaCl和HCl。
(4)B点溶液中溶质NaCl的质量分数∶![]() ×100%=16.3%。
×100%=16.3%。
点睛∶灵活应用质量守恒定律,正确书写化学方程式是顺利完成本题的重要保证。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图所示A~G是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B和C含有相同的元素。
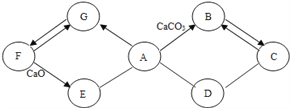
(1)写出F的化学式_______,E物质的一种用途___________,C物质的一条化学性质___________。
(2)C和D反应需要高温,写出它们反应的化学方程式_________________。
(3)A→B反应的化学方程式是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】侯德榜先生是我国制碱工业的先驱和奠基人,其生产的产品纯碱和副产品氯化铵工艺流程如图所示:
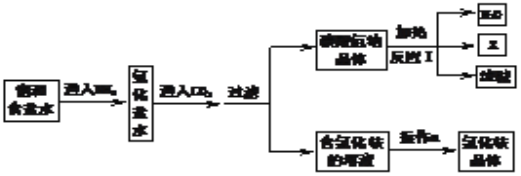
(1)NH3溶于水得到氨水。将无色酚酞溶液滴入氨水中,溶液呈______色。
(2)写出反应Ⅰ的化学方程式____________________________。
(3)上述工艺流程中可循环利用的物质是__________(水除外)。
(4)氯化氨在农业上可作氮肥,但不能与熟石灰混合施用。原因是_________(用化学方程式表示)。
(5)写出氨碱法生产碳酸氢钠的反应原理:_____________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
(提出问题)硝酸铜在加热条件下到底发生了怎样的反应?
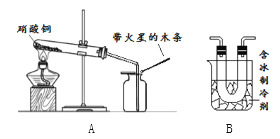
(查阅资料)
(1)氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4
 CuSO4+H2O
CuSO4+H2O(2)含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
(3)NO2有助燃性,能使带火星的木条复燃
(猜想假设)
Cu(NO3)2受热分解除了生成_____________,还可能生成了CuO和O2。
(进行实验)
实验操作
实验现象
实验结论
(1)将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入____________,加热
固体全部溶解,得到_____色溶液
硝酸铜分解生成了氧化铜。
(2)在图A的试管和集气瓶之间连上图B所示的装置,重新进行加热硝酸铜的实验
集气瓶中气体为无色,带火星木条复燃
硝酸铜分解________(“有”或“无”)氧气生成。
步骤(2)是同学们查阅了新的资料后才设计完成的。该资料体现的是有关二氧化氮______的物理性质信息。
(获得结论)根据实验结果,Cu(NO3)2受热分解的化学方程式为________________。
(反思与评价)
已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小希对某变化的微观示意图(如图所示)有如下的看法,正确的是( )
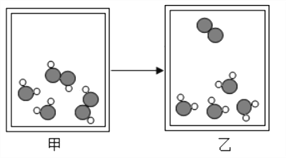
A. 这是一个汽化过程,属于物理变化
B. 这是一个化学变化,反应物与生成物的微粒个数比为4:4:1
C. 若示意图表示双氧水制取氧气,则甲图可代表过氧化氢溶液,属于混合物
D. 该反应中涉及到的几种物质都含有氧元素,都属于氧化物
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明对于蜡烛燃烧过程进行了一系列的探究,下列说法正确的是( )
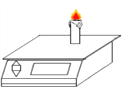
A. 点燃蜡烛后,电子秤示数逐渐减小(如图所示),蜡烛减小的质量等于燃烧后生成物的总质量
B. 在燃烧的蜡烛上方罩上干冷烧杯,看到有水雾生成,说明蜡烛中一定含有氢氧两种元素
C. 将大烧杯罩在燃烧蜡烛中,一会儿,蜡烛熄灭,说明蜡烛燃烧生成二氧化碳
D. 已知蜡烛的主要成分CxHy燃烧的方程式是
 ,则物质的化学式是C25H32
,则物质的化学式是C25H32 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关碳及其化合物说法不正确的是( )
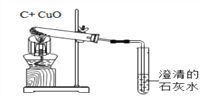
A. 石墨、金刚石、C60由于原子排列方式不同,所以它们的性质不同
B. CO为可燃性气体,点燃前应该先验纯
C. 二氧化碳气体通入紫色石蕊试液,溶液变红,可见二氧化碳与水生成的物质显酸性
D. 上图是用木炭还原氧化铜,该反应的化学方程式为:CuO+C
 Cu+CO↑
Cu+CO↑
相关试题

