【题目】下图所示A~G是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B和C含有相同的元素。
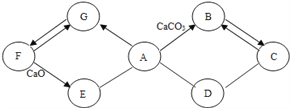
(1)写出F的化学式_______,E物质的一种用途___________,C物质的一条化学性质___________。
(2)C和D反应需要高温,写出它们反应的化学方程式_________________。
(3)A→B反应的化学方程式是______________。
参考答案:
【答案】 H2O 建筑材料(合理即可) 冶炼金属(燃料) 3CO+Fe2O3![]() 2Fe+3CO2 CaCO3+2HCl=CaCl2+H2O+CO2↑
2Fe+3CO2 CaCO3+2HCl=CaCl2+H2O+CO2↑
【解析】A是人体胃液中含有的酸,A是盐酸,G是最轻的气体,G是氢气,B和C含有相同的元素,B是二氧化碳,C是一氧化碳。(1)F的化学式是H2O,E是氢氧化钙,E物质的一种用途是建筑材料。C物质的一条化学性质是冶炼金属或作燃料。(2)C和D反应需要高温,它们反应的化学方程式是3CO+Fe2O3![]() 2Fe+3CO2。(3)A→B反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑。
2Fe+3CO2。(3)A→B反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑。
点睛∶物质的结构决定物质的性质,物质的性质决定物质的用途。掌握常见物质的性质和用途是顺利完成本题的重要保证。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我省中考体考使用了“体能测试专用跳绳”,专用跳绳的包装上有这样的介绍:“绳内核为强力钢丝材料,外围为优质TPU塑料,整体柔韧性和悬垂性好,不易磨损和打结”。请你回答下面的问题:
(1)中考专用绳的外围材料属于什么材料______________;
A.金属材料 B.合成材料 C.复合材料
(2)内核为强力钢丝,它与纯铁相比的优点是________________(写一点即可);
(3)兴趣小组的同学切下一截钢丝并投入稀盐酸中浸泡,一段时间后,溶液呈浅绿色,出现该现象的化学方程式为:_____。
(4)铁是世界年产量最高的金属,请写出用CO还原赤铁矿炼铁的化学方程式_____________。
(5)向硝酸银和硝酸铜的混合溶液中,插入一截钢丝,反应一段时间后取出钢丝,则钢丝上一定有____,写出发生该反应的化学反应方程式_________________。整个反应的过程中溶液的质量(填“增大”或“减小”)___________;。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃
0
20
40
60
80
100
溶解度/g
Ca(OH)2
0.19
0.17
0.14
0.12
0.09
0.08
NaOH
31
91
111
129
313
336
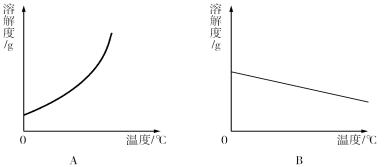
(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶度曲线的是 (填“A”或“B”);
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙 ②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度 ⑥加入生石灰。
其中措施正确的是 ;
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体的质量为 ;
(4)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时溶液中溶质的质量
乙 甲(填“>”、“<”或“=”);
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH固体,应采取的物理方法是 ;
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列装置常用于实验室制取气体。根据给出的装置回答下列问题:
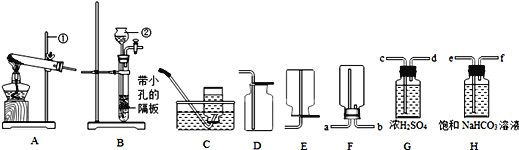
(1)指出编号仪器的名称:①__________②__________;
(2)实验室用氯酸钾和二氧化锰混合制取氧气的发生装置为_____,写出该反应的化学方程式_____,反应前后二氧化锰的质量分数_____(填“增大”、“减小”或“不变”);
(3)制取并收集二氧化碳应选择的装置是_______(从A~E中选择),使用该套装置制取气体的突出优点是_________,若改用F装置收集二氧化碳,则气体应从______端进入;
(4)实验中制得的二氧化碳中常含有少量的水蒸气和氯化氢气体,欲使用G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→(____)→(____)→(____)→(_____)(用端口字母表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】侯德榜先生是我国制碱工业的先驱和奠基人,其生产的产品纯碱和副产品氯化铵工艺流程如图所示:
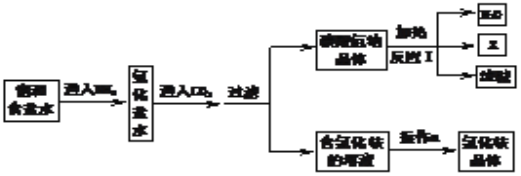
(1)NH3溶于水得到氨水。将无色酚酞溶液滴入氨水中,溶液呈______色。
(2)写出反应Ⅰ的化学方程式____________________________。
(3)上述工艺流程中可循环利用的物质是__________(水除外)。
(4)氯化氨在农业上可作氮肥,但不能与熟石灰混合施用。原因是_________(用化学方程式表示)。
(5)写出氨碱法生产碳酸氢钠的反应原理:_____________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
(提出问题)硝酸铜在加热条件下到底发生了怎样的反应?
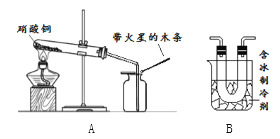
(查阅资料)
(1)氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4
 CuSO4+H2O
CuSO4+H2O(2)含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
(3)NO2有助燃性,能使带火星的木条复燃
(猜想假设)
Cu(NO3)2受热分解除了生成_____________,还可能生成了CuO和O2。
(进行实验)
实验操作
实验现象
实验结论
(1)将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入____________,加热
固体全部溶解,得到_____色溶液
硝酸铜分解生成了氧化铜。
(2)在图A的试管和集气瓶之间连上图B所示的装置,重新进行加热硝酸铜的实验
集气瓶中气体为无色,带火星木条复燃
硝酸铜分解________(“有”或“无”)氧气生成。
步骤(2)是同学们查阅了新的资料后才设计完成的。该资料体现的是有关二氧化氮______的物理性质信息。
(获得结论)根据实验结果,Cu(NO3)2受热分解的化学方程式为________________。
(反思与评价)
已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】阳光中学化学兴趣小组的同学为测定某纯碱(Na2CO3)样品中(只含有少量的氯化钠杂质)碳酸钠的质量分数,现称取12.0g样品放入烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为44.1g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示。试计算:
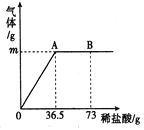
(1)A点产生气体的质量为_________;
(2)该样品中碳酸钠的质量分数?(精确到0.1%,下同)__________
(3)B点时,烧杯内溶液中溶质的化学式___________。
(4)B点溶液中溶质NaCl的质量分数____________?
相关试题

