【题目】(8分)钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加适量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是___________(填字母)。加Na2CO3溶液的作用是除去________。
用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有:
②如果配制后溶液溶质的质量分数低于0. 9%,你认为可能的原因是 (写一个即可)
(2)海水制镁。从海水中提取金属镁的过程如下图所示:
![]()
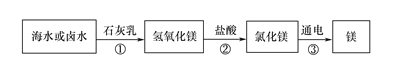
在上述转化过程中发生中和反应的方程式是 ________________ 。海水中本身就含有氯化镁,则①、②两步的作用是_______________
(3)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 _____
参考答案:
【答案】(1)a c d b e 除氯化钙和过量的氢氧化钡 1.8
①量筒、胶头滴管、烧杯、玻璃棒 ②读数时采用仰视读数或氯化钠中有杂质
(2)Mg(OH)2+2HCl==MgCl2+2H2O 使镁离子富集
(3)NH3+CO2+NaCl+H20=NaHCO3+NH4Cl
【解析】
试题分析:(1)加过量的Ba(OH)2溶液是除去硫酸镁杂质,而加过量的Na2CO3溶液除氯化钙和过量的氢氧化钡,故c一定要放在a之后,故正确的操作顺序是a c d b e ;加Na2CO3溶液的作用是除去:除氯化钙和过量的氢氧化钡;根据溶质质量分数的表达式,配制200g0.9%的生理盐水,需要NaCl的质量=200g ×0.9%=1.8g
①配制溶液的步骤:计算、称量、量取、溶解,故所需要的玻璃仪器有:量筒、胶头滴管、烧杯、玻璃棒
②如果配制后溶液溶质的质量分数低于0. 9%,根据溶质质量分数的表达式,要不是溶质质量偏小,要不就是溶剂质量偏大,故可能的原因是:读数时采用仰视读数或氯化钠中有杂质等
(2)中和反应是酸和碱作用生成盐和水的反应,故化学反应方程式是:Mg(OH)2+2HCl==MgCl2+2H2O; 海水中本身就含有氯化镁,则①、②两步的作用是:使镁离子富集
(3)氨碱法制纯碱,是将氨气、二氧化碳通入到饱和的食盐水中生成NaHCO3和NH4Cl,反应的化学方程式为:NH3+CO2+NaCl+H20=NaHCO3+NH4Cl
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是四种实验操作中各量变化关系的图像,能正确反映其对应操作的图像有
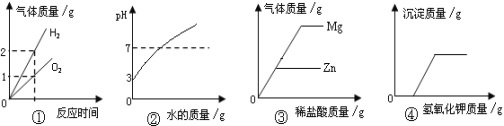
①电解水
②向一定量pH=3的盐酸溶液中不断加水稀释
③向等质量的镁和锌中分别加入溶质质量分数相同的稀盐酸至过量
④向盐酸和氯化铜的混合溶液中不断滴加氢氧化钾溶液
A.4个 B.3个 C.2个 D.1个
-
科目: 来源: 题型:
查看答案和解析>>【题目】(7分)某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
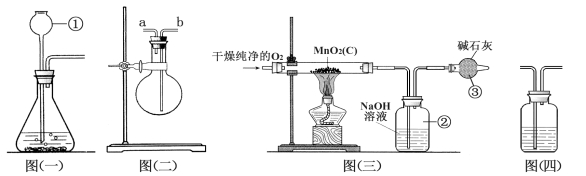
(1)仪器①的名称是 。如果该实验选择图㈠装置来制取氧气,反应的化学方程式为 。
(2)用图㈡装置可收集和干燥氧气:若烧瓶充满水来收集氧气,气体应从 (填“a”或“b”,下同)端通入;若在烧瓶内装入浓硫酸进行干燥气体,气体应从 端通入。
(3)图㈢是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,装置③中装有碱石灰,其作用是____________________________。
(4)为验证图㈢中装置②已将CO2吸收完全,可在装置②与③之间加入图㈣装置进行证明,则图㈣装置中加入的试剂为______(填字母)。
A. NaOH溶液 B. 澄清石灰水 C. 浓硫酸
(5)称取5.0 g二氧化锰样品进行实验,图㈢中装置②反应前后的质量差为1.1 g,则样品中二氧化锰的质量分数为____________(填计算结果)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是
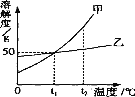
A.t1℃时,甲、乙两种物质的溶解度都是50g
B.t2℃时,在两种饱和溶液中,溶质的质量甲一定大于乙
C.t2℃时,将甲的饱和溶液降温至t1℃,其溶质的质量分数减小
D.t1℃时,将30g甲放到50g水中,所得溶液的溶质质量分数为37.5%
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到25g该石灰石样品中,得到如下部分数据和图象:
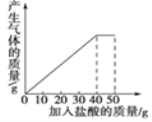
次数
第1次
第2次
第3次
加入盐酸的质量/g
10
10
10
剩余固体的质量/g
20
15
10
请计算:(1)石灰石样品中杂质的质量为 g。
(2)所加盐酸的溶质质量分数.
-
科目: 来源: 题型:
查看答案和解析>>【题目】化肥碳酸氢铵具有以下性质:易溶于水,受潮时在常温下即能分解放出氨气,温度越高分解越快,遇碱性物质时也会放出氨气.该化肥在运输、贮存和施用中做法错误的是( )
A.运输时注意密封
B.贮存时不能受潮或曝晒
C.与草木灰混合施用
D.施用后立即盖上
-
科目: 来源: 题型:
查看答案和解析>>【题目】(4分)锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下。市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效。下图是某品牌葡萄糖酸锌口服液的
标签,请根据标签信息回答:

(1)葡萄糖酸锌中各元素的质量比 ;
(2)葡萄糖酸锌中锌元素的质量分数 (精确到0.1%)。
(3)某患者除正常饮食吸锌元素外,还需服用该品牌葡萄糖酸锌口服液。若治疗一个疗程需补充104mg锌元素,而这些锌有75%来自该口服液,则患者共需服用 支葡萄糖酸锌口服液?(简写出解题过程)
相关试题

