【题目】良好有效的学习方法能使人产对知识的理解更深刻、掌握更牢固,而且不同的知识点采用不同的学习方法,让我们在理解知识的同时,更有效率地学习.
首先归纳方法:如图A是我们复习时归纳出氢氧化钙的化学性质(连线表示相互反应)和它的一种工业制备方法.请回答下列问题:

(1)熟石灰(主要成分是氢氧化钙)可由生石灰(主要成分是氧化钙)和水反应生成,请写出反应的化学方程式: .为了验证氢氧化钙的性质①,将无色酚酞试液加到氢氧化钙溶液中,液体呈现 色.
(2)氢氧化钙在工农业生产中有广泛的应用,如某化工厂排放的污水中主要污染物是盐酸,可用成本较低的熟石灰进行处理,写出该反应的化学方程式 .
(3)用石灰浆(主要成分是氢氧化钙)抹墙,是利用氢氧化钙与空气中的二氧化碳反应,生成坚硬的碳酸钙;写出该反应的化学方程式 .
(4)用氢氧化钙溶液和碳酸钠溶液反应可制取氢氧化钠,图B是该反应的微观示意图,写出该反应的化学反应方程式: .由图可知该反应的微观实质是 .从该图可以看出,反应前后没有发生变化的微观粒子有 .
再如学科思想方法:如“具体→抽象”的思想,通过对氢氧化钙、氢氧化钠性质的认识,抽象得出:碱溶液中都含有 离子,正是由于该离子的存在,导致碱具有相似的化学性质,称作碱的通性.碱的通性有 .(请任写一条).
参考答案:
【答案】(1)CaO+H2O═Ca(OH)2;红;
(2)Ca(OH)2+2HCl═CaCl2+2H2O;
(3)Ca(OH)2+CO2=CaCO3↓+H2O;
(4)NaOH+HCl=NaCl+H2O;氢离子和氢氧根离子结合成水分子;
Na+,Cl﹣;氢氧根;能使紫色的石蕊试液变蓝色.
【解析】(1)写出氧化钙与水反应制取氢氧化钙,反应物为氧化钙和水,生成物为氢氧化钙,故化学方程式:CaO+H2O═Ca(OH)2;其水溶液显碱性,能使无色的酚酞试液变红色;故填:CaO+H2O═Ca(OH)2;红;
(2)熟石灰是氢氧化钙的俗称,与盐酸反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O.故填:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)氢氧化钙与二氧化碳反应,故用石灰浆(主要成分是氢氧化钙)抹墙,是利用氢氧化钙与空气中的 二氧化碳反应,生成坚硬的碳酸钙;故填:Ca(OH)2+CO2=CaCO3↓+H2O;
(4)氢氧化钠和盐酸反应的发生,用化学反应方程式表示为NaOH+HCl=NaCl+H2O,反应的实质是氢离子和氢氧根离子结合成水分子.反应前后没有发生变化的微观粒子有Na+,Cl﹣.碱溶液都能电离出氢氧根离子,所以具有相似的化学性质,如能使紫色的石蕊试液变蓝色,无色的酚酞试液变红色等.
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属﹣锂(Li),被称为“21世纪的能源金属”,当前手机中广泛使用的电池,主要是高能锂电池.请回答下列问题:
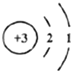
(1)锂原子的结构示意图如图所示:锂原子在化学反应中容易 (选填“得到”或“失去”)电子变成离子,其离子符号为 .
(2)研究表明,锂的金属活动性比铁活泼.写出金属锂与稀硫酸反应的化学方程式 .
(3)金属锂除用于制造锂电池外,还可用于储存氢气,其原理是金属锂与氢气化合生成白色粉末状的氢化锂(LiH),氢化锂与水反应生成氢氧化锂和氢气.写出上述过程中发生反应的化学方程式 , .
(4)氢氧化锂是一种易溶于水的白色固体,有辣味;化学性质与氢氧化钠相似,有强碱性和腐蚀性.载人航天飞船中常用氢氧化锂代替氢氧化钠来吸收航天员呼吸产生的二氧化碳,则氢氧化锂和二氧化碳反应的化学方程式为 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合如图所示回答问题:

(1)实验室中用过氧化氢溶液与二氧化锰混合制取氧气,发生反应的化学方程式为: ;应选用的发生装置是 .(选填装置序号,下同)
(2)氨气是一种无色有刺激性气味、极易溶于水、密度比空气小的气体,其水溶液呈碱性.实验室常用加热氯化铵和熟石灰的固体混合物制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O,所以应选用的发生装置是 ,应选用的收集装置是 .实验室中选择气体发生装置时,应考虑的因素是 和 .
CaCl2+2NH3↑+2H2O,所以应选用的发生装置是 ,应选用的收集装置是 .实验室中选择气体发生装置时,应考虑的因素是 和 . -
科目: 来源: 题型:
查看答案和解析>>【题目】空气是一种宝贵的自然资源,下列措施中,不利于提高空气质量的是
A.开发新能源代替化石燃料 B.改进汽车尾气的净化技术
C.节假日燃放烟花爆竹 D.控制PM2.5的排放以减少雾霾天气
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质放入水中,能形成溶液的是( )
A.豆油 B.面粉 C.汽油 D.白糖
-
科目: 来源: 题型:
查看答案和解析>>【题目】用科学方法认识和改造物质.请你参与探究并填空:
按照科学认识的过程,科学方法主要蕴含在二个阶段:一是感性认识阶段,主要是为了获得证据,如观察、预测、实验等;二是理性认识(理性思维)阶段,主要是为了形成科学认识,如科学抽象、科学假说,像比较与对比、归纳与演绎等.
在前一阶段的学习中,我们通过实验、观察等手段验证了很多化学反应的发生,运用了“归纳、演绎;比较、对比”等科学的一般方法认识了几种典型的酸、碱、盐.请你运用以上方法认识氯化镁.
(1)用归纳/演绎的方法认识氯化镁的性质
已知下列反应:
HCl+AgNO3═AgCl↓+HNO3
NaCl2+AgNO3═AgCl↓+NaNO2
BaCl2+2AgNO3═2AgCl↓+Ba(NO3)2…
①这组反应能够发生的原因是 .
②由①中得到的规律可以推论“氯化镁溶液也能跟硝酸银溶液反应”,运用的是 的方法.
(2)用实验的方法认识氯化镁的性质
①要验证(1)②中“氯化镁溶液也能跟硝酸银溶液反应”的推论,需进行实验,实验方法是:
实验操作
实验现象
结论
结论:氯化镁溶液能跟硝酸银溶液反应
②用实验的方法认识氯化镁的其他性质
实验操作
实验现象
结论
取少量氯化镁溶液于试管中,然后再滴加2﹣3滴紫色石蕊试液,振荡
石蕊试液变红
结论:氯化镁溶液
取少量氯化镁溶液于试管中,然后再滴加氧化钠溶液
产生白色沉淀
结论:
(3)用重要的学科实验方法﹣﹣“化学转化法”改造物质
人类利用化学变化,创造出我们所需要的物质,极大地促进了人类社会的发展.工业上以海水为原料,通过一系列化学变化可以得到氯化镁晶体;将无水氯化镁(MgCl2)在熔融状态下,通电后可以得到“国防金属”镁.反应流程如图所示,请从化学视角回答下列问题:
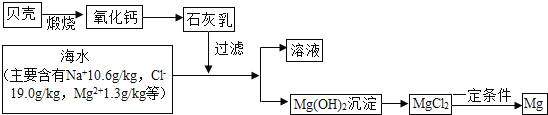
①要使海水中的MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳(主要成分是氢氧化钙)要过量.请同学设计实验确定海水中的MgCl2已全部转化为Mg(OH)2;取上层清液少量于试管中,向其中加入 ,观察到 ,说明海水的MgCl2已全部转化为Mg(OH)2.
②要将沉淀出的氢氧化镁转化为氯化镁,可以选用的试剂是 .
③海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化过程的原因: .
-
科目: 来源: 题型:
查看答案和解析>>【题目】“酒香不怕巷子深”说明了( )
A.分子之间有间隔 B.分子总是在不断运动
C.分子的体积变大 D.化学变化中分子可分
相关试题

