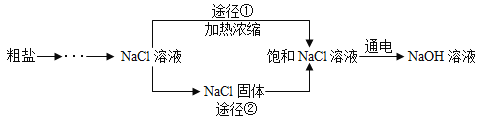
【题目】某同学设计的工业制备氢氧化钠的流程如下图。
资料:
![]() ,两电极,一端得到NaOH和
,两电极,一端得到NaOH和![]() ,另一端得到
,另一端得到![]() 。
。
(1)晾晒海水得到粗盐的原理是________________。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和_________。
(3)工业生产中应选择途径_______(“①”或“②”),理由是_________________。
(4)![]() 可用于生产84消毒液(有效成分
可用于生产84消毒液(有效成分![]() ),反应原理为
),反应原理为![]() ,反应前后氯元素的化合价有________种。
,反应前后氯元素的化合价有________种。
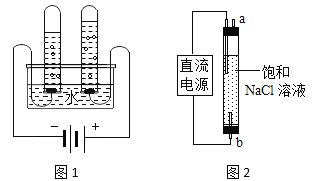
(5)图1实验测定水的组成,不能加入NaCl增强水的导电性的理由是_________。
(6)图2实验获得84消毒液,直流电源正极应与_____(填“a”或“b”)连接,才能使![]() 的含量更高。
的含量更高。
参考答案:
【答案】蒸发结晶 蒸发皿 ① 步骤简便,节约能源 3 会生成![]() ,干扰实验结果 b
,干扰实验结果 b
【解析】
(1)氯化钠的溶解度受温度变化影响较小,所以晾晒海水得到粗盐的原理是蒸发结晶;
(2)实验室蒸发用到的仪器还有蒸发皿;
(3)根据流程图可以看出,途径①没有将氯化钠蒸干,只是进行了浓缩,工业生产中应选择途径①,理由是途径①的步骤简便,节约能源;
(4)反应前氯气中氯元素为0价,反应后氯化钠中氯元素的化合价为-1价,反应后次氯酸钠中氯元素的化合价为+1,所以反应前后氯元素的化合价有3种。
(5)要测定水组成,不能加入NaCl增强水的导电性是因为加氯化钠会生成氯气,干扰实验结果。电解水时生成氢气和氧气,化学方程式为2H2O![]() 2H2↑+O2↑,
2H2↑+O2↑,
(6)图3实验获得84消毒液,分别在阴极与阳极生成氢气(H2)与氯气(Cl2),为了使氯气被完全吸收,直流电源正极应与b连接,才能使NaClO的含量更高。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语书写正确的是(_______)
A.两个氮分子:
 B.两个氢原子:
B.两个氢原子: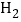
C.钙离子:
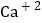 D.铵根的化合价为________
D.铵根的化合价为________ -
科目: 来源: 题型:
查看答案和解析>>【题目】请缩变到微观世界,认真审视下列球球(微粒)的变化过程,下列说法正确的是(_______)
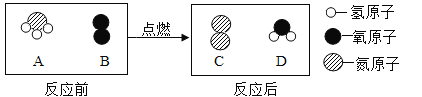
A.反应生成C和D的质量比为14:9
B.A中氮元素与氢元素的质量比为1:3
C.物质D是氧化物
D.该反应中化合价不变的元素是______
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是A、B、c三种固体物质的溶解度曲线,下列说法中正确的是(_____)
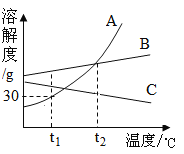
A.
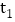 ℃时,65gA的饱和溶液中含有50g溶剂
℃时,65gA的饱和溶液中含有50g溶剂B.在
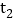 ℃,A、B两种物质的溶液溶质质量分数相同
℃,A、B两种物质的溶液溶质质量分数相同C.将
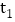 ℃A、B、C三种物质的饱和溶液升温至
℃A、B、C三种物质的饱和溶液升温至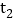 ℃时,溶液中溶质质量分数由小到大的顺序为C<B=A
℃时,溶液中溶质质量分数由小到大的顺序为C<B=AD.当A中含有少量B时,提纯A的方法是____________
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究,
[提出问题]二氧化碳与氢氧化钠反应,还是溶解在水中?
[查阅资料]
①15℃、101KPa时,二氧化碳的溶解度如表:
溶液
水
酒精
溶解度
1.0
0.3
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
[实验设计]在15℃、101KPa时,制取二氧化碳并用于实验甲、实验乙。
[分析与表达]
(1)实验前,两套装置都进行气密性检查。实验甲装置气密性检查的方法是____________。
(2)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是_______________。
(3)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是__________,(填答案字母)
A.先慢后快 B.先快后慢 C.先慢后快。再变慢实验乙中,还可能观察到的现象是____________。
(4)实验乙中,120mL酒精______(填“能”或“不能”)换成水,原因是_______________。
(5)实验乙结束时,注射器中酒精体积为20mL,则与氢氧化钠反应的二氧化碳体积至少是________mL.
(6)由以上探究可知,二氧化碳能溶于水。也能氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有_____________。(写一条)
-
科目: 来源: 题型:
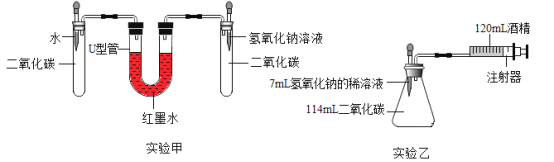
查看答案和解析>>【题目】化学小组同学讲生锈的铁钉分别放入稀盐酸和稀硫酸中加热,发现稀盐酸除铁锈后溶液变为黄色,而稀硫酸除铁锈后溶液仍为无色。这激发了他们的探究兴趣,请你共同完成。
写出稀盐酸除铁锈的化学方程式:_______________________。
[提出问题]为什么氯化铁溶液呈黄色而硫酸铁溶液无色?
[查阅资料]
 的水溶液呈黄色,遇酸会褪色。
的水溶液呈黄色,遇酸会褪色。[猜想与假设]根据查阅资料,同学们一致认为硫酸铁溶液含有
 ,溶液应该是黄色,其呈现无色的原因可能是____________。
,溶液应该是黄色,其呈现无色的原因可能是____________。[进行实验]
[现象与结论](1)②中是_________溶液,则猜想正确。
(2)根据实验,对比②④中的溶液颜色,同学们认为氯化铁溶液为黄色,可能是___________。
(3)请你再设计一个实验证明氯化铁溶液呈黄色的原因。实验方案:取试管①中的溶液,_______________
(请描述必要的实验操作和现象)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组取部分变质的
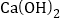 (含杂质
(含杂质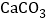 )样品4.0g投入200.0g水中,充分搅拌,通入足量
)样品4.0g投入200.0g水中,充分搅拌,通入足量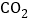 ,溶液质量与反应的
,溶液质量与反应的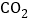 质量的关系如图所示[已知:
质量的关系如图所示[已知: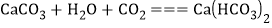 ].则:
].则: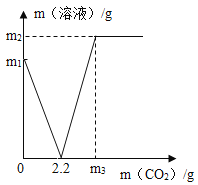
(1)
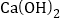 全部转化为
全部转化为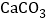 时消耗
时消耗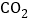 的质量为_______g;
的质量为_______g;(2)4.0g样品中杂质
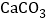 的质量为多少_______?(写出计算过程)
的质量为多少_______?(写出计算过程)(3)通入
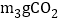 时,溶液中生成物的溶质质量分数为_______(精确到0.1%).若所取样品中的
时,溶液中生成物的溶质质量分数为_______(精确到0.1%).若所取样品中的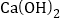 没有完全溶于水,对最后的计算结果________(填“有”或“没有”)影响,原因是_________________。
没有完全溶于水,对最后的计算结果________(填“有”或“没有”)影响,原因是_________________。
相关试题

