【题目】某化学兴趣小组取部分变质的![]() (含杂质
(含杂质![]() )样品4.0g投入200.0g水中,充分搅拌,通入足量
)样品4.0g投入200.0g水中,充分搅拌,通入足量![]() ,溶液质量与反应的
,溶液质量与反应的![]() 质量的关系如图所示[已知:
质量的关系如图所示[已知:![]() ].则:
].则:
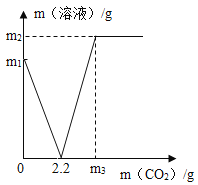
(1)![]() 全部转化为
全部转化为![]() 时消耗
时消耗![]() 的质量为_______g;
的质量为_______g;
(2)4.0g样品中杂质![]() 的质量为多少_______?(写出计算过程)
的质量为多少_______?(写出计算过程)
(3)通入![]() 时,溶液中生成物的溶质质量分数为_______(精确到0.1%).若所取样品中的
时,溶液中生成物的溶质质量分数为_______(精确到0.1%).若所取样品中的![]() 没有完全溶于水,对最后的计算结果________(填“有”或“没有”)影响,原因是_________________。
没有完全溶于水,对最后的计算结果________(填“有”或“没有”)影响,原因是_________________。
参考答案:
【答案】2.2 0.3g(详见解析) 4.1% 没有 不溶干水的氢氧化钙最终也和二氧化碳反应生成碳酸氢钙
【解析】
(1)由图示可知Ca(OH)2和CO2反应全部转化为CaCO3时消耗的CO2质量是2.2g;
(2)设4.0g样品中Ca(OH)2质量为x,生成碳酸钙的质量为y。
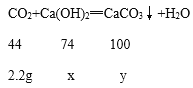
![]() x=3.7g;
x=3.7g;
![]() y=5g;
y=5g;
4.0g样品中杂质CaCO3的质量=4.0g-3.7g=0.3g;
(3)Ca(OH)2和CO2反应全部转化为CaCO3后,碳酸钙的质量=5g+0.3g=5.3g;
设:碳酸钙全部溶解时消耗二氧化碳的质量为m,生成碳酸氢钙的质量为n。
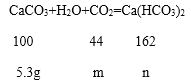
![]() m=2.332g;
m=2.332g;
![]() n=8.586g;
n=8.586g;
通入m3gCO2时,碳酸钙已全部反应,生成碳酸氢钙,溶液中生成物的溶质的质量分数=![]() ;
;
若所取样品中的Ca(OH)2没有完全溶于水,未溶解的氢氧化钙也能与二氧化碳生成碳酸钙,故对最后的计算结果没有影响。
-
科目: 来源: 题型:
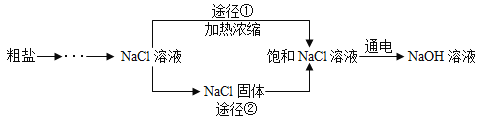
查看答案和解析>>【题目】某同学设计的工业制备氢氧化钠的流程如下图。
资料:
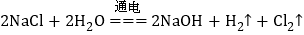 ,两电极,一端得到NaOH和
,两电极,一端得到NaOH和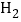 ,另一端得到
,另一端得到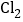 。
。(1)晾晒海水得到粗盐的原理是________________。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和_________。
(3)工业生产中应选择途径_______(“①”或“②”),理由是_________________。
(4)
 可用于生产84消毒液(有效成分
可用于生产84消毒液(有效成分 ),反应原理为
),反应原理为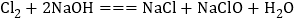 ,反应前后氯元素的化合价有________种。
,反应前后氯元素的化合价有________种。(5)图1实验测定水的组成,不能加入NaCl增强水的导电性的理由是_________。
(6)图2实验获得84消毒液,直流电源正极应与_____(填“a”或“b”)连接,才能使
 的含量更高。
的含量更高。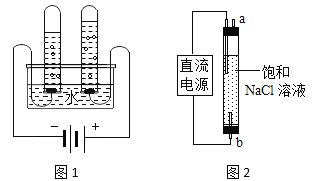
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究,
[提出问题]二氧化碳与氢氧化钠反应,还是溶解在水中?
[查阅资料]
①15℃、101KPa时,二氧化碳的溶解度如表:
溶液
水
酒精
溶解度
1.0
0.3
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
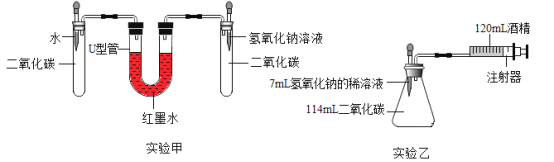
[实验设计]在15℃、101KPa时,制取二氧化碳并用于实验甲、实验乙。
[分析与表达]
(1)实验前,两套装置都进行气密性检查。实验甲装置气密性检查的方法是____________。
(2)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是_______________。
(3)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是__________,(填答案字母)
A.先慢后快 B.先快后慢 C.先慢后快。再变慢实验乙中,还可能观察到的现象是____________。
(4)实验乙中,120mL酒精______(填“能”或“不能”)换成水,原因是_______________。
(5)实验乙结束时,注射器中酒精体积为20mL,则与氢氧化钠反应的二氧化碳体积至少是________mL.
(6)由以上探究可知,二氧化碳能溶于水。也能氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有_____________。(写一条)
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学小组同学讲生锈的铁钉分别放入稀盐酸和稀硫酸中加热,发现稀盐酸除铁锈后溶液变为黄色,而稀硫酸除铁锈后溶液仍为无色。这激发了他们的探究兴趣,请你共同完成。
写出稀盐酸除铁锈的化学方程式:_______________________。
[提出问题]为什么氯化铁溶液呈黄色而硫酸铁溶液无色?
[查阅资料]
 的水溶液呈黄色,遇酸会褪色。
的水溶液呈黄色,遇酸会褪色。[猜想与假设]根据查阅资料,同学们一致认为硫酸铁溶液含有
 ,溶液应该是黄色,其呈现无色的原因可能是____________。
,溶液应该是黄色,其呈现无色的原因可能是____________。[进行实验]
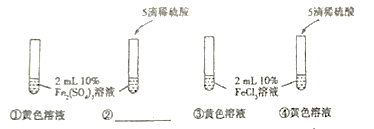
[现象与结论](1)②中是_________溶液,则猜想正确。
(2)根据实验,对比②④中的溶液颜色,同学们认为氯化铁溶液为黄色,可能是___________。
(3)请你再设计一个实验证明氯化铁溶液呈黄色的原因。实验方案:取试管①中的溶液,_______________
(请描述必要的实验操作和现象)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】规范的实验操作是实验成功的保证。下列实验操作错误的是( )
A.
 加入固体粉末 B.
加入固体粉末 B. 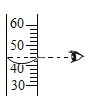 读取液体体积
读取液体体积C.
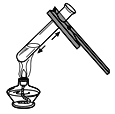 加热液体物质 D.
加热液体物质 D. 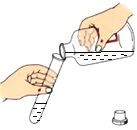 倾倒液体物质
倾倒液体物质 -
科目: 来源: 题型:
查看答案和解析>>【题目】如图是两种气体发生反应的微观示意图:
 下列叙述不正确的是( )
下列叙述不正确的是( )A. 生成物一定是混合物
B. 该反应属于化合反应
C. 反应前后分子种类发生了变化
D. 反应前后元素化合价发生了变化
-
科目: 来源: 题型:
查看答案和解析>>【题目】在20℃时,某固体物质(不含结晶水)的水溶液,经历如图变化,下列说法正确( )
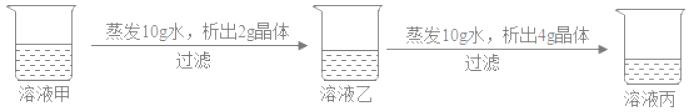
A. 溶液甲是饱和溶液
B. 20℃时,溶液丙若蒸发10g水,析出晶体一定大于4g
C. 溶液乙是饱和溶液
D. 溶液质量分数:乙<丙
相关试题

