【题目】最近,我国科学家成功合成新型催化剂,将CO2高效转化为甲醇(CH3OH)。这不仅可以缓解碳排放引起的温室效应,还将成为理想的能源补充形式。该化学反应的微观过程如下图所示。下列说法正确的是
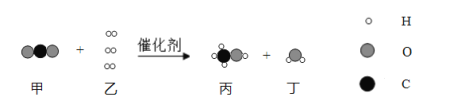
A. 该反应中四种物质均为化合物 B. 反应前后H元素的化合价不变
C. 参加反应的甲、乙分子个数比为1:3 D. 反应前后原子数目发生改变
参考答案:
【答案】C
【解析】根据微观示意图可知:CO2和H2在条件下转化为甲醇(CH3OH)和水,其化学方程式为:CO2+3H2![]() CH3OH+H2O。A、 根据化学方程式可知,反应物中的氢气是单质,该反应中四种物质不是均为化合物,错误;B、反应前的H元素的化合价为0,反应后水中H元素化合价为+1价,反应前后H元素的化合价发生改变,错误;C、根据化学方程式可知, 参加反应的甲、乙分子个数比为1:3,正确;D、根据化学反应的微观过程可知,反应前后原子数目没有发生改变,正确。故选C。
CH3OH+H2O。A、 根据化学方程式可知,反应物中的氢气是单质,该反应中四种物质不是均为化合物,错误;B、反应前的H元素的化合价为0,反应后水中H元素化合价为+1价,反应前后H元素的化合价发生改变,错误;C、根据化学方程式可知, 参加反应的甲、乙分子个数比为1:3,正确;D、根据化学反应的微观过程可知,反应前后原子数目没有发生改变,正确。故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
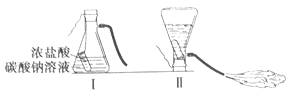
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤
实验现象
实验结论
__________________
__________________
猜想3正确
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H2O
 Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算: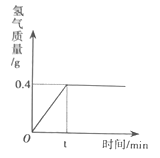
(1)氯化钠完全反应时生成氢气的质量是_________g。
(2)氯化钠完全反应时,生成氢氧化钠的质量是_________克?
(3)原氯化钠溶液中溶质的质量分数是_________?
-
科目: 来源: 题型:
查看答案和解析>>【题目】锌是促进人体生长发育的必须微量元素。下图为锌元素在元素周期表中的相关信息及原子结构示意图。下列说法正确的是( )
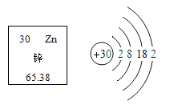
A. 锌属于非金属元素 B. 锌原子的中子数为30
C. 锌的相对原子质量为65.38g D. 锌原子在化学反应中易失去电子形成Zn2+
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是( )

A. 甲和乙的溶解度相等且均为30g
B. 甲物质的溶解度随温度的升高而减小
C. a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D. 将a2℃150g甲的饱和溶液降温到t1℃,有20g固体析出
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为A~G(初中常见物质)的转化关系,其中A是天然气的主要成分。
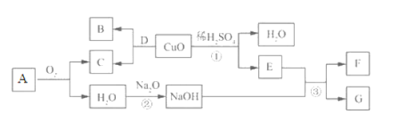
根据以上信息回答下列问题:
(1)写出A 的化学式:________,其常见用途为_________________(任写一条)。
(2)反应①的现象为________________________________。
(3)写出反应②的化学方程式 _________________________,该反应属于_________反应(填基本反应类型)。
(1)写出反应③的化学方程式 ___________________________________。
(2)Na2O与CaO的化学性质相似,下列物质中______________(填标号)能与Na2O发生化学反应。
a.Mg b.N2 c.稀盐酸 d.NaCl固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂,向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
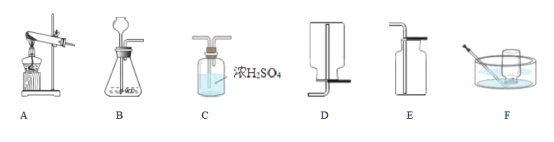
①写出用H2O2溶液制备O2的化学方程式:____________________________________。
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为_______→ __________→ ________(填标号)。为了确保实验成功,在装药品之前应该_________。
③检验O2的方法是___________________________ ,若木条复燃,则证明收集的气体为O2。
(2)FeCl3溶液做催化剂
向5mL5%的H2O2溶液中加入2滴一定浓度的 FeCl3溶液,立即产生大量气泡。
(已知)FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl-
(问题)那种微粒对H2O2溶液的分解起催化作用?
(假设)假设一:可能是H2O
假设二:可能是Fe3+
假设三:可能是Cl-
(分析)①假设一不可能成立,理由是__________________________________________。
(实验)
操作
现象
其他条件不变,向H2O2溶液中加入NaCl溶液
无明显变化
其他条件不变,向H2O2溶液中加入Na2SO4溶液
无明显变化
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液
立即产生大量气泡
(结论)②假设___成立,而假设一和另一种假设不成立。
③催化剂比较从循环利用的角度分析,_____(填化学式)更适合做该反应的催化剂。
相关试题

