【题目】某化学兴趣小组的同学在教师的指导开展如下探究活动.
(一)推断:某白色固体粉末甲可能含有硫酸铜、碳酸钠、氢氧化钠、氯化钠、硫酸钠中的一种或几种, 为探究它们的组成,开展了以下实验.
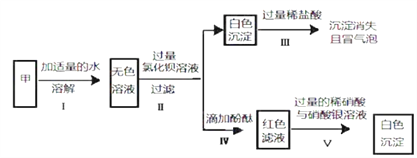
(1)甲加水后形成无色溶液的 pH____7(填“大于”、“小于”或“等于”);
(2)加水形成无色溶液说明固体甲一定不含____;
(3)将上述框图中某试剂稍作改动,可以证实可能有的物质不存在,改动操作及不存在该物质的现象 为____;
(二)除杂:乙溶液中主要含有氯化钠、还含有少量的氯化钙、氯化镁、硫酸钠杂质,现欲提纯氯化钠 开展以下实验.
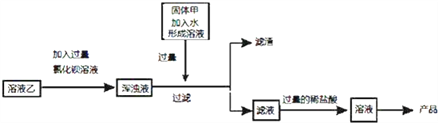
(4)过量稀盐酸的作用是____;
(5)若“过量氯化钡溶液”与“过量固体甲”颠倒位置添加,则最后溶液中含有的溶质一定 是____;
(6)最后得到的产品中所含氯化钠的质量____溶液乙中氯化钠的质量(填“>”“<”或“=”)
参考答案:
【答案】 大于 硫酸铜 过量的氯化钡改为过量的硝酸钡溶液,步骤Ⅴ中无明显现象 去除过量的氢氧化钠与碳酸钠 氯化钡、氯化钠、氯化氢 >
【解析】根据所学知识和题中信息知,(一)推断:某白色固体粉末甲可能含有硫酸铜、碳酸钠、氢氧化钠、氯化钠、硫酸钠中的一种或几种。(1)甲加水后形成无色溶液的pH大于7,碳酸钠和氢氧化钠溶液均呈碱性,氯化钠和硫酸钠溶液均呈中性,无色溶液中加入过量的氯化钡溶液产生碳酸钡白色沉淀,碳酸钡与盐酸反应产生气体二氧化碳,一定含有碳酸钠;通过Ⅲ这一过程沉淀全部消失,一定没有硫酸钠,硫酸钡是不溶于酸的白色沉淀;通过Ⅴ这一过程产生不溶于稀硝酸的白色沉淀,沉淀应是氯化银,一定有氯化钠;通过Ⅳ溶液变红,一定含有氢氧化钠。(2)加水形成无色溶液说明固体甲一定不含硫酸铜,硫酸铜溶液呈蓝色。(3)将上述框图中某试剂稍作改动,可以证实可能有的物质不存在,改动操作及不存在该物质的现象为过量的氯化钡改为过量的硝酸钡溶液,步骤Ⅴ中无明显现象。(二)除杂:乙溶液中主要含有氯化钠、还含有少量的氯化钙、氯化镁、硫酸钠杂质,现欲提纯氯化钠。(4)过量稀盐酸的作用是去除过量的氢氧化钠与碳酸钠。(5)通过上述分析白色粉末甲一定含有碳酸钠,氯化钠和氢氧化钠,一定不含有硫酸铜。若“过量氯化钡溶液”与“过量固体甲”颠倒位置添加,氯化钙与碳酸钠反应生成碳酸钙白色沉淀,氯化镁与氢氧化钠反应生成氢氧化镁白色沉淀,则最后溶液中含有的溶质一定是氯化钡、氯化钠、氯化氢。
点睛∶碳酸钠溶液呈碱性,碳酸钡与盐酸或硝酸反应,硫酸钡和氯化银均是不溶于酸的白色沉淀。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:SiO2不与稀盐酸反应。牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏对牙齿的摩擦和去污,牙膏摩擦剂一般由CaHPO4、 CaCO3、 Al(OH)3、SiO2中的一种或几种组成。牙膏中只有摩擦剂不溶于水。请回答下列问题:
(1)上述几种物质中属于盐的是CaCO3和______(填化学式);Al(OH)3的名称是_________。
(2)已知某品牌牙膏中的摩擦剂是CaCO3、Al(OH)3和SiO2中的一种或两种,将适量的牙膏溶于水,静置后过滤,向滤渣中加入足量稀盐酸,没有观察到气泡,且有不溶物,则该牙膏中一定不含______,一定含______。
(3)用下图所示装置(夹持仪器略去)测定另一品牌牙膏中碳酸钙的含量。请回答下列问题:
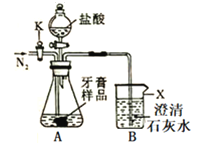
①装置B中仪器X的名称是______。
②装置A中滴加盐酸反应完全后,打开活塞K缓缓通入N2,其作用是_______。
③准确称取5.0g牙膏样品进行实验,测得B中沉淀质量为1.2g。则样品中碳酸钙的质量分数为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示Ⅰ~Ⅴ装置,可供实验室制取有关气体时选用.
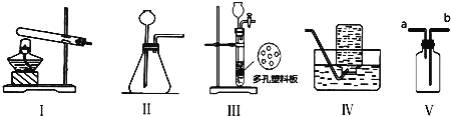
下列有关说法不正确的是( )
A. 实验室制取 CO2 或 O2 可选用Ⅱ、Ⅳ装置
B. 实验室用锌粒和稀硫酸制取 H2 可选用Ⅱ、Ⅳ装置
C. 用氯酸钾制取干燥的氧气可选用Ⅰ、Ⅴ装置,且氧气从 b 端进入
D. 装置Ⅲ与Ⅱ相比,其优点是能控制反应的速率
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示:
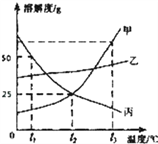
(1)甲在 t2℃时的溶解度为____;
(2)t1℃时 30g 丙与 50g 水充分溶解形成____(填“饱和”或“不饱和”)溶液;
(3)甲的饱和溶液中含有少量的乙可以采用____ 提纯甲.
(4)下列说法错误的是____(填序号).
A.从 t3℃甲、乙、丙的饱和溶液降温到 t2℃时,析出晶体最多的是甲
B.将 t2℃50g 丙的饱和溶液加水稀释成溶质质量分数为 10%的丙溶液,需要用到的仪器有:烧 杯、玻璃棒、量筒(50ml)、胶头滴管
C.t2℃乙的饱和溶液中加入固体甲,乙的溶质的质量分数不变
D.t3℃等质量甲、乙、丙的饱和溶液中,含溶剂最多的是丙
E.将接近饱和的甲溶液变成甲的饱和溶液,溶质质量分数可能不变.
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室现有一种含有纯碱、小苏打的固体粉末样品.为了测定其中小苏打的含量,某化学兴趣小组的同学在老师的指导下,利用如下图所示装置(部分固定装置已略去)进行实验.加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为:2NaHCO3
 Na2CO3+CO2↑+H2O。碱石 灰是 CaO 与 NaOH 的固体混合物;已知,该装置气密性良好,A、C、D 中所装药品足量且能完全吸收 相关物质.探究过程如下:
Na2CO3+CO2↑+H2O。碱石 灰是 CaO 与 NaOH 的固体混合物;已知,该装置气密性良好,A、C、D 中所装药品足量且能完全吸收 相关物质.探究过程如下: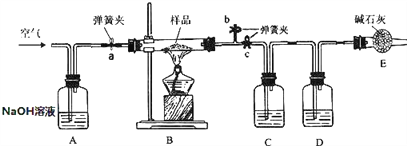
Ⅰ.称量样品和已装入相关药品的 C、D 质量,分别为:m、mC1、,mD1.
Ⅱ.将质量为 m 的样品装入 B 玻璃管中,按图连接好装置,进行操作 X.
Ⅲ.关闭弹簧夹 a、b,打开弹簧夹 c,给玻璃管加热.
Ⅳ.待玻璃管中样品完全反应,打开弹簧夹 a 通入空气,再熄灭酒精灯,直到玻璃管冷却. Ⅴ.再次称量 C、D 的质量,分别为 mC2、mD2.请回答下列问题:
(1)步骤Ⅱ中操作 X 具体为____;
(2)C 中所装药品为____;
(3)D 中发生反应的化学方程式为____;
(4)步骤Ⅳ打开弹簧夹 a 通入空气,再熄灭酒精灯,直到玻璃管冷却的多重作用是____;
(5)依据实验实际,选择实验所得数据,该样品中小苏打含量的表达式为____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图能正确反映其对应操作中各量的变化关系的是




A.向等质量的镁和锌中加 入相同的稀盐酸至过量
B.用等质量、等浓度的过氧化氢溶液制取氧气
C.高温煅烧一定质量的石灰石
D.氢氧化钠溶液中浓度加足量的水稀释
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
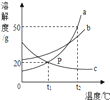
A. t2 ℃时,将50g a物质放入50g水中充分溶解得到100g a的饱和溶液
B. 将t2 ℃时a、b、c三种物质的饱和溶液降温至t1 ℃时,所得溶液的溶质质量分数关系是b > a > c
C. t2 ℃时a、b两种物质饱和溶液降温到t1 ℃时,析出晶体质量 a>b
D. t2 ℃时,将等质量的a、b、c三种固体放入水中完全溶解形成的饱和溶液的质量由大到小的顺序为: a > b > c
相关试题

