【题目】有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙。为探究其组成进行如下实验,主要流程及现象记录如下:
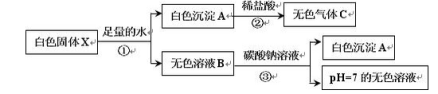
回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有 ;
(2)步骤②中发生反应的化学方程式 ;
(3)步骤③中产生白色沉淀A的化学方程式 ;G
(4)白色固体X中的物质有 ;
参考答案:
【答案】(1)CuSO4
(2)CaCO3 + 2HCl=CaCl2 + H2O +CO2↑
(3)CaCl2 + Na2CO3=CaCO3 ↓ + 2NaCl
(4)NaCl CaCl2 CaCO3
(5) 加水溶解,加入适量的Na2CO3溶液,过滤,向滤液中滴加稀盐酸至不在产生气泡,后蒸发溶液,当有较多固体出现时,停止加热——得到氯化钠固体
【解析】
试题分析∶由题中信息知,样品加水,生成白色沉淀和无色溶液,故无硫酸铜,白色沉淀和盐酸反应生成无色气体,故有由碳酸钙,无色溶液加入碳酸钠溶液,得白色沉淀,故有氯化钙,得PH=7无色溶液,故无氢氧化钙。故⑴白色固体X中一定没有硫酸铜。⑵步骤②中发生反应的化学方程式是CaCO3 + 2HCl=CaCl2 + H2O +CO2↑ (3)步骤③中产生白色沉淀A的化学方程式是 CaCl2 + Na2CO3=CaCO3 ↓ + 2NaCl (4)由此可知,白色固体X中的物质有 NaCl CaCl2 CaCO3 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中硫元素化合价最低的是
A.H2S B.H2SO3 C.S D.H2SO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是某气体在另一种气体中燃烧的微观示意图,其中○和●分别表示氯原子和氢原子。请回答:
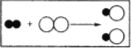
(1)上述化学反应的基本类型是 反应。
(2)生成的物质溶于水后,是一种重要的化工原料,请写出一个有它参加的中和反应的化学方程式 。
(3)通过该反应过程,关于燃烧的条件你有什么新的发现 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据相关信息回答问题:
(1)有X、Y、Z三种金属,它们之间能够发生如下反应:Y + X(NO3)2 == X + Y(NO3)2,X + Z(NO3)2 == Z + X(NO3)2 。问:X、Y、Z三种金属的活动性由强到弱的顺序是 ① 。
与金属跟盐反应的规律相似,非金属也有这样的规律。Br2、I2、C12及其化合物间有如下关系:Br2 + 2NaI==2NaBr+ I2;C12 + 2NaI == 2NaCI + I2;C12 + 2NaBr == 2NaCl + Br2。非金属单质Br2、I2、C12的化学活动性由强到弱的顺序为 ② 。
(2)“绿色化学”强调采取有效措施防止对环境的破坏和污染。
硫在氧气中燃烧实验前,往集气瓶中加适量NaOH溶液,再进行实验,原因是(用化学方程式表示) ③ 。
在汽车排气管上装一个“催化转换器”,可使汽车尾气中的NO和CO反应,生成能参与大气生态循环的两种无毒气体。NO与CO反应的化学方程式为 ④ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下列装置,回答问题:
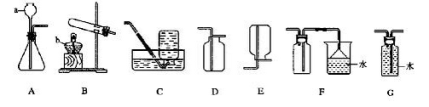
(1)写出仪器名称:a , b
(2)实验室若用A装置制取氧气,a中应加入 ,反应的化学方程式 ;A装置还可以制取 气体,你的理由 ;
(3)某同学利用装置B、C组合制取氧气时,发现水槽中水变 ,可能的原因是 ;
(4)资料:
①乙炔(C2H2)又名电石气,由固体CaC2(俗称电石)与水反应制得。反应较为剧烈。
②乙炔(C2H2)无色无味气体,常常因含杂质H2S、PH3等气体而有特殊的臭味。由于乙炔微溶于水,密度比空气稍小,故不用排空气法收集乙炔气体。
a:实验室制取乙炔应选用的发生装置是 (填序号),且根据反应的需要有一处需要改进。改进的方法是 。
b:防止收集乙炔气体时里面所含杂质的特殊臭味对空气造成污染 最好用 (填序号)来收集。
-
科目: 来源: 题型:
查看答案和解析>>【题目】区别二氧化碳、氧气和空气三种气体,应采用的方法是
A. 将燃烧的木条分别伸入集气瓶中 B. 将气体分别通入水中
C. 将气体分别通入澄清石灰水中 D. 分别观察颜色
-
科目: 来源: 题型:
查看答案和解析>>【题目】对下列实验现象的描述不正确的是
A.硫在空气中燃烧发出明亮的蓝紫色火焰
B.镁在空气中燃烧生成白色固体
C.红磷在空气中燃烧冒出大量的白烟
D.细铁丝在氧气中燃烧火星四射
相关试题

