【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。
参考答案:
【答案】 2Al+6HCl===2AlCl3+3H2↑ 反应温度 ① ② 300 s<t<500 s 用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等)
【解析】(1)熟练掌握铝与盐酸的反应;
(2)比较②和③可以看出它们的不同之处是在于温度;
(3)②和③中盐酸浓度相等,故能表明盐酸浓度对反应影响的是①和②;
(4)把盐酸浓度改为4%那么此时浓度在3%和6%之间,所以反应所需时间也应该在这之间;
(5)计算反应快慢的方法很多,例如产生相同体积的气体的所需时间长短、产生气泡的快慢等都能够衡量反应快慢。
答:(1)铝与盐酸反应是置换反应,要生成氢气![]() ;
;
(2)②中盐酸浓度为6%温度为![]() ,③中盐酸浓度为6%温度为
,③中盐酸浓度为6%温度为![]() ,可以看出③所需时间较短,从而可以判断温度不同所需时间也不同;
,可以看出③所需时间较短,从而可以判断温度不同所需时间也不同;
(3)比较①和②中的数据可以知道浓度越大反应所需时间越短;
(4)浓度为3%所需时间为500秒,浓度为6%所需时间为300秒,那么当浓度为4%时,所需时间应该在300秒至500秒之间;
(5)判断一个反应的快慢有多种方法,有气体产生的可以通过产生气泡的快慢来判断反应的快慢,还可以通过温度升高的快慢来判断等;
因此,本题正确答案是:(1)![]() (2)温度
(2)温度
(3)①和② (4) 300 s<t<500 s
(5)用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等)
-
科目: 来源: 题型:
查看答案和解析>>【题目】4支试管中分别盛有相同质量分数的稀盐酸,将A、B、C和锌四种金属分别同时放入其中。小明将观察到的现象形象地画了一幅卡通图(如下图所示),每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体。

(1)A、B、C三种金属的活动性由强到弱的顺序可能是 。
(2)B是常见金属,写出B和盐酸反应的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有氢气、氧气、一氧化碳、乙醇、氦气、氯化钠等六种物质,请按要求填写下列空白(用化学式填写).
(1)支持燃烧的气体是 ;(2)可用于制造低温环境的是 ;(3)可用于酒精灯、火锅、内燃机等的燃料是 ;(4)由离子构成的是 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】将品红滴入热水和冷水中,实验现象如下表所示:
实验过程
冷水
热水
开始
红色扩散较慢
红色扩散较快
长久放置
最终成为红色均匀、透明的液体
依据此实验现象,下列解释中,不正确的是( )
A. 分子是由原子构成的
B. 分子间有间隔
C. 分子总是在不停的运动着
D. 温度升高,分子运动速率加快
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下四位同学对分子和原子的认识正确的是( )
A. 分子构成物质而原子不能构成物质 B. 原子由原子核和核外电子构成
C. 分子运动而原子不运动 D.分子可分而原子不可分
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】铁的活动性比铜强。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_________; 猜想三:Fe>Cu>R
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作
主要现象
实验结论
甲
将打磨好的R丝插入盛有硫酸铜溶液的试管中
____________
猜想一正确
乙
将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中
R丝表面产生气泡速率比铁丝表面产生气泡速率_________(填“快”或“慢”)
丙
将粗细相同打磨好的R丝、铁丝,分别在空气中点燃
R丝在空气中剧烈燃烧,铁丝在空气中____________
写出铁丝在氧气中燃烧的化学方程式____________________。
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)盒属与_________是否反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某工厂废液中含有氯化铜和氯化亚铁,某课外小组要将废液进行处理并得到铜和氧化铁两种产品,过程如图所示。
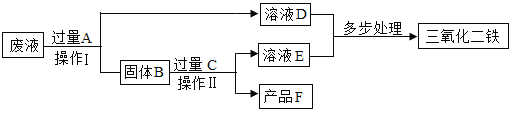
(1)加入A物质发生的化学反应方程式为______________________________;
(2)操作Ⅰ和Ⅱ的名称是________,其中除用到烧杯、漏斗和铁架台外,还需要的玻璃仪器是__________;
(3)检验C过量的方法是____________________________;
(4)经过处理后,氧化铁中铁元素________(选填“等于”“小于”或“大于”)原废液中氯化亚铁中铁元素质量。
相关试题

