【题目】有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。下列说法正确的是
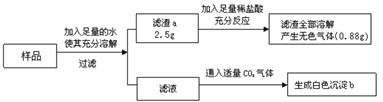
A. 滤渣a一定有碳酸钙,一定没有硫酸钡、可能有氢氧化镁
B. 沉淀b是由氯化钡与二氧化碳反应生成
C. 滤液中溶质一定有氯化钡、氯化钠,一定没有氢氧化钠
D. 若“滤渣全部溶解”变为“部分溶解”,其它现象不变,则原样品中不能确定是否存在的物质是氯化镁
参考答案:
【答案】D
【解析】(1)硫酸钡沉淀不溶解于稀盐酸,碳酸钙沉淀能和盐酸反应生成易溶于水的氯化钙、水、二氧化碳。因为向滤渣中加入足量的稀盐酸后,滤渣全部溶解,可判断出滤渣中无硫酸钡沉淀,根据滤渣中加盐酸能产生无色气体,且滤渣全都溶解,可知滤渣a一定有碳酸钙,一定没有硫酸钡;
设产生0.88g二氧化碳时,参加反应的碳酸钙质量是x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.88g
100:44=x:0.88g解得x=2g而滤渣的质量是2.5g,故滤渣a的成分是CaCO3、Mg(OH)2,氢氧化镁沉淀是由氢氧化钠与氯化镁反应产生的。向滤液中通入适量CO2气体生成白色沉淀,则该沉淀只能是碳酸钡,可知滤液中含有NaOH、BaCl2(相当于有氢氧化钡和氯化钠),白色沉淀b的成分BaCO3,是由氢氧化钡和二氧化碳反应生成;若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则沉淀中含有碳酸钙、硫酸钡,不能确定是否含有氢氧化镁沉淀,故原样品中不能确定是否存在的物质是氯化镁,正确。故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铁在高温条件下与氧化铜反应:2Fe+3CuO
 Fe2O3+3Cu 铜在氯化铁溶液中发生反应:Cu+2FeCl3 = 2FeCl2+CuCl2。一定质量的铁与氧化铜的混合物在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后过滤,得到固体甲和滤液乙。取适量滤液乙于试管中,加入一定质量的锌粉,充分反应。
Fe2O3+3Cu 铜在氯化铁溶液中发生反应:Cu+2FeCl3 = 2FeCl2+CuCl2。一定质量的铁与氧化铜的混合物在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后过滤,得到固体甲和滤液乙。取适量滤液乙于试管中,加入一定质量的锌粉,充分反应。①固体甲中一定含Cu,一定不含Fe
②滤液乙中一定含有FeCl2、CuCl2,一定不含FeCl3
③若充分反应后Zn无剩余,溶液中若有CuCl2,则一定有FeCl2
④若充分反应后Zn无剩余,溶液中若无CuCl2,则可能有FeCl2
⑤若充分反应后Zn有剩余,则溶液中有ZnCl2,无CuCl2,可能有FeCl2
其中正确的个数有
A. 2个 B. 3个 C. 4个 D. 5个
-
科目: 来源: 题型:
查看答案和解析>>【题目】从“丝绸之路”到“一带一路”的倡议,促进了东西方经济、文化的交流.
(1)“丝绸之路”把中国的丝绸、茶叶等传入西方,将西方的宝石等传入中国。
①丝绸的主要成分是_______ 。
A.纤维素 B.蛋白质 C.糖类 D.维生素
②新鲜茶叶中含维生素C,缺乏会得________病。
③宝石的成分复杂,其中所含的Al2O3 ______金属材料(选填“是”或“否”)。写出铝离子的符号 _______ 。
(2)能源合作是“一带一路”的重要内容,中缅油气管道将石油和天然气输入中国。
①将石油分离得到汽油、煤油等不同产品是_____(选填“物理变化”或“化学变化”)。
②写出天然气燃烧的方程式______________________ ;做饭时,燃气灶的火焰呈黄色,锅底出现黑色,则需要调大炉具进风口,其原理:__________________ 。
③温室效应是由CO2、CO、SO2气体中的 __________气体造成的。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我们已经学习过实验室制取一些气体的反应原理、发生装置及收集方法,请根据下列实验装置图回答问题:
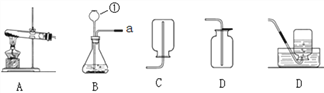

(1)写出装置图中标号仪器的名称:①_________。
(2)如选用装置A作为制取氧气的发生装置,其化学方程式可以为_________________。
(3)实验室使用稀盐酸和金属锌制取氢气的化学反应方程式为__________________,这种方法制得的氢气往往含有少量杂质气体,若用B、E、F等装置制取并收集纯净的氢气,则装置的接口顺序为:a→(____) (____) →(____) (____) →收集,其中E中所放的药品为 ________ 。
(4)为了验证二氧化碳与氢氧化钠可以发生化学反应,某小组用下图所示装置进行实验。请回答下列问题:
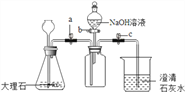
①打开止水夹a和c,关闭活塞b,从长颈漏斗向锥形瓶中注入稀盐酸,使长颈漏斗下端管口浸没在液面下的原因是___________________ 。
②当观察_______ (填实验现象)时,说明集气瓶中已集满二氧化碳气体。再向集气瓶中加入适量的NaOH溶液后,关闭活塞a、b,轻轻振 荡集气瓶。一段时间后可观察到___________,证明二氧化碳与氢氧化钠发生了化学反应。二氧化碳与氢氧化钠反应的化学方程式为:______________ 。
③有同学认为仅做上述实验不严密,应利用上图装置做一个对比实验。该对比实验所选的试剂是 _________ ,产生的现象与上述实验不同的是______________________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:
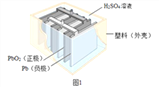
(1)图1铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4═2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断_____(填“增大”、“减小”或“不变”)。
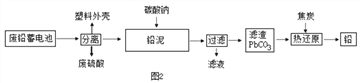
(2)如图2是回收废铅蓄电池的一种工艺流程。
①写出焦炭热还原生成铅的化学方程式: ________________________
②将流程图中的废硫酸和滤液按一定比例混合,再将所得的混合液经____、降温结晶、过滤等操作,可以析出Na2SO4·10H2O晶体。
③如表是一些金属熔点的数据:
金属
锡
铅
铋
镉
熔点∕℃
231.9
327.5
271.3
320.9
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为________________。
A. 231.9-327.5℃ B.271.3-320.9℃ C.60-80℃ D.20-40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
物质
CaCO3
NH3
Ca(OH)2
市场参考价(元/kg )
1.8
6.5
2.0
已知:2NH3+H2SO4═(NH4)2SO4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择_________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】镍粉常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
I.(镍粉制备):工业用电解镍新液(主要含NiSO4、NiCl2)制备碱式碳酸镍晶体xNiCO3yNi(OH)2zH2O,并利用其制备镍粉的流程如下:
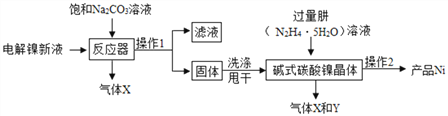
(1)反应器中一个重要反应为:3NiSO4+3Na2CO3+2H2O=NiCO32Ni(OH)2↓+3Na2SO4+2X,X的化学式为____。
(2)操作1名称是_____ , 洗涤操作1所得固体时,需用纯水洗涤,检验其洗净的方法(写出步骤、现象)___________________ 。
(3)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中95%酒精浸泡的目的 ______。
(4)物料在反应器中反应时需控制反应条件。分析下图,反应器中最适合的温度及pH分别为 ________________________ 。
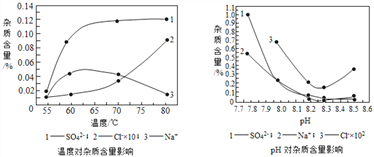
(5)生产中,pH逐渐增加,生成Ni(OH)2量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将__________填“升高”、“降低”或“不变”)。
Ⅱ.(测定碱式碳酸镍晶体的组成)
为测定碱式碳酸镍晶体(xNiCO3yNi(OH)2zH2O组成,某小组设计了如下实验方案及装置:
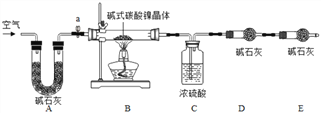
(资料卡片)
(1)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O
(2)400℃左右,NiO会氧化生成Ni2O3.
(实验步骤):
①连接装置,_______ ;②准确称取3.77g xNiCO3yNi(OH)2zH2O放在B装置中,连接仪器;③打开弹簧夹a,缓缓鼓入一段时间空气,称量装置C、D的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤___________;⑥准确称量装置C、D的质量;⑦根据数据进行计算(相关数据如下表)
装置C/g
装置D/g
装置E/g
加热前
200.00
180.00
180.00
加热后
201.08
180.44
180.00
(实验分析及数据处理):
(1)完善实验步骤中的填空:① 连接装置,_______ ;⑤___________。
(2)装置A的作用: 实验开始前、实验完毕时分别是__________________________
(3)计算xNiCO3yNi(OH)2zH2O中x:y:z的值是______________。(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室可用氯酸钾和二氧化锰混合加热制取氧气,固体混合物的质量与时间的关系如图。下列分析错误的是

A. 反应结束时生成了(a-b)g氧气
B. P点处固体成分是氯酸钾和氯化钾
C. 从t1到t2固体混合物中氯元素的质量分数不断增大
D. 该反应前后MnO2质量保持不变
相关试题

