【题目】现取8.0 g石灰石样品放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内物质总质量为42.3 g(气体全部逸出),产生气体的质量与加入的稀盐酸的质量关系如图所示。(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)试计算 :
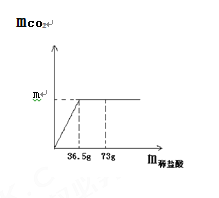
(1)m = ________。
(2)该石灰石样品中碳酸钙的质量分数是多少__________?
参考答案:
【答案】 2.2g 62.5%
【解析】(1)根据质量守恒定律可知,减少的质量即为生成的二氧化碳的质量;(2)根据生成二氧化碳的质量结合反应的化学方程式求解碳酸钙的质量,从而求解碳酸钙的质量分数。(1)由质量守恒定律可知,m=反应物的总质量-反应后各物质的总质量=6g+36.5g-40.3g=2.2g;(2)设石灰石样品中碳酸钙的质量为x。
CaCO3+ 2HCl = CaCl2+H2O+CO2↑
100 44
x 2.2g
![]()
x=5g
该石灰石样品中碳酸钙的质量分数=![]() ×100%=62.5%
×100%=62.5%
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明要参加期末考试,他妈妈为了给他增加营养,制定了如右表所示的食谱。

(1) 米饭中主要含有的营养素是_____________,
为了使营养均衡,你建议应该增加的食物是________________。(写一种)
(2)下列关于钙的说法中,正确的是_________。 (选填序号)
①为了防止缺钙,青少年应大量吃钙片 ②幼儿或青少年缺钙可能患佝偻病
(3)小明妈妈在厨房用到的下列物品中,所使用的主要材料属于天然纤维的是__________,属于金属材料的是_________。(选填序号)
①铁锅 ②棉布围裙 ③合成橡胶手套
-
科目: 来源: 题型:
查看答案和解析>>【题目】海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。
I .从海水中获得氯化钠。将海水进行____________可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是______。(用序号填一种合理组合)。
II.海水提溴。工业上常用“吹出法”制溴,其工艺流程如下:
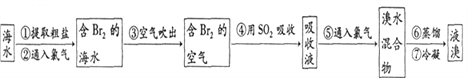
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应基本类型_________________。
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 、Br2+2KI=2KBr+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是 _______________。
III.从海水中得到金属镁。下图是从海水中提取镁的简单流程。
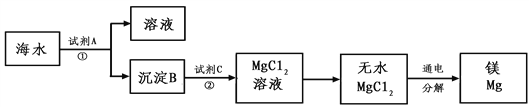
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为______,由无水MgCl2制取Mg的化学方程式为____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知草酸(H2C2O4)加热时在浓硫酸的作用下会发生分解反应,某化学兴趣小组对其分解产物进行了如下探究.
(提出猜想)
(1)分解产物是一氧化碳和水蒸气的混合物.
(2)分解产物是二氧化碳和水蒸气的混合物.
(3)分解产物是一氧化碳、二氧化碳和水蒸气的混合物.
你认为合理的猜想是 _________(选填序号),依据是_________。
(查阅资料)
(1)浓硫酸具有脱水性,可以将有机物中的氢、氧元素按水的组成脱去.
(2)白色的无水硫酸铜遇水会变为蓝色.
(3)碱石灰是固体氢氧化钠和氧化钙的混合物.
(进行实验)为了检验草酸的分解产物的成份,小组同学将草酸的分解产物通过下图所示的装置(部分夹持仪器已略去).
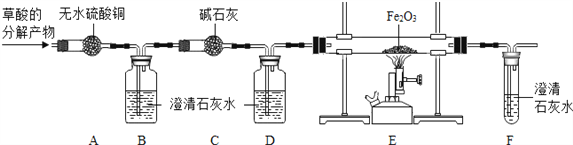
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,证明草酸分解产生了________________ 。
(2)装置D的作用是________________ 。
(3)证明草酸分解产生了一氧化碳的现象应包括_________________.
(4)装置B中发生反应的化学方程式为___________,装置E中发生反应的化学方程式为________.
(得出结论)草酸分解的化学方程式为_________________.
(反思与评价)从环保角度考虑,上述实验的不足之处是____________ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是
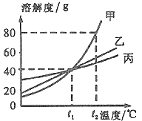
A. t1℃时甲、乙、丙三者的溶解度相等
B. t1℃时甲、乙、丙三者饱和溶液的溶质质量分数相等
C. 要使t1℃时甲的饱和溶液变成不饱和溶液可以采取升高温度的方法
D. t2℃时,往100g水中加入90g甲,充分搅拌后得到190g甲的溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲和乙反应可制备燃料丙,其微观示意图如下。下列说法正确的是( )
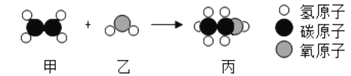
A. 甲、丙分别在氧气中完全燃烧,产物相同 B. 该反应中分子和原子的种类都发生改变
C. 丙、乙都是氧化物 D. 该反应不属于化合反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定量的盐酸和氯化钙混合溶液中逐滴滴入碳酸钠溶液,且参加反应的碳酸钠溶液的质量与生成沉淀的质量之间的关系如图所示。则下列说法正确的是 ( )
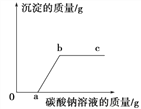
A. 反应过程中没有气泡
B. a点所处状态的溶液中溶质只有一种
C. b点比c点所处状态的溶液中氯化钠的质量分数小
D. ab线段上任意一点对应溶液的pH=7
相关试题

