【题目】铁及其化合物应用广泛。
(一)铁及其化合物的应用
①下图3为某小儿硫酸亚铁糖浆。
(1)适当服用该糖浆可治疗______________(选填序号)。
A.佝偻病 B.侏儒症 C.贫血症
(2)图中不涉及到的材料是_________________(选填序号)。
A.无机材料 B.合成材料 C.复合材料

②食品保鲜“双吸剂”含铁粉、食盐等,上图4为其原理探究实验:
(1)滴入食盐水后,关闭分液漏斗活塞。一段时间后,铁粉上出现红色固体,气球______(选填“变大”、“不变”或“变小”)。
(2)食盐水的作用是______。
(二)铁及其化合物的实验
(1)将废铁屑加入滴有洗涤剂的热水中,充分搅拌以除去油污,这利用了洗涤剂的______作用。
(2)取干燥后的过量铁屑溶于一定量的稀H2SO4(水浴加热控制在50~80℃),搅拌、静置、过滤、洗涤,检验铁粉已洗净的方法是________。
(3)向上述所得滤液中加入饱和(NH4)2SO4溶液,经蒸发浓缩、________、过滤等操作得到浅蓝绿色晶体。
(查阅资料)常见含铁元素的浅蓝绿色晶体有:①硫酸亚铁晶体[FeSO47H2O];
②硫酸亚铁铵晶体[FeSO4(NH4)2SO46H2O]。
(4)取一定量晶体样品,溶于适量水,加入足量的______溶液,微热,并把产生的气体通入酚酞试液,酚酞试液变成______色,说明该晶体是硫酸亚铁铵晶体。
(三)硫酸亚铁铵晶体的热分解实验
兴趣小组称取此晶体样品39.2g,在科研人员的指导下用下图装置进行热分解实验。
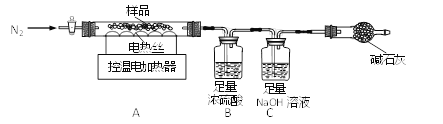
(查阅资料)①硫酸亚铁铵晶体(相对分子质量为392)在100℃完全失去结晶水,剩余物在500℃完全分解为铁的某氧化物、SO2、SO3、NH3和H2O。
②B装置中浓硫酸只能吸收NH3、SO3和H2O。
(1)装配好实验装置后,先要________。
(2)加热前后及过程中均通入N2,停止加热后继续通N2的目的是防止倒吸和________。
(3)控制不同的温度对A中固体加热,测得装置B和C中的质量变化如下表。
温度/℃ | 室温 | 100 | 500 |
B装置/g | 200.00 | x | 228.00 |
C装置/g | 100.00 | 100.00 | 103.20 |
①表格中x =________。
②最终生成SO3的质量为________g,铁的某氧化物的化学式为________。
参考答案:
【答案】 C C 变大 加快铁生锈 乳化 取最后一次洗涤后的滤液,滴加BaCl2溶液,无现象 降温结晶(或冷却结晶或结晶) NaOH溶液 红 检查装置的气密性 使生成的气体被相应装置完全吸收 210.8 12 Fe2O3
【解析】(一) ①(1)适当服用硫酸亚铁糖浆可治疗贫血症; (2)图中涉及到的塑料属于合成材料,铝盖属于金属材料,玻璃为无机非金属材料,没有涉及到复合材料;② (1)滴入食盐水后,关闭分液漏斗活塞。一段时间后,由于铁生锈,铁粉上出现红色固体,因氧气减少,压强变小,气球变大;(2)食盐水的作用是加速铁的锈蚀;(二) (1)将废铁屑加入滴有洗涤剂的热水中,充分搅拌以除去油污,这利用了洗涤剂的乳化作用;(2)取干燥后的过量铁屑溶于一定量的稀H2SO4(水浴加热控制在50~80℃),搅拌、静置、过滤、洗涤,检验铁粉已洗净的方法是:取最后一次洗涤后的滤液,滴加BaCl2溶液,没有沉淀生成;(3)向上述所得滤液中加入饱和(NH4)2SO4溶液,经蒸发浓缩、降温结晶、过滤等操作得到浅蓝绿色晶体;【查阅资料】(4)铵根离子和氢氧根离子结合生成氨气和水。氨气和水结合生成氨水,呈碱性。取一定量晶体样品,溶于适量水,加入足量的氢氧化钠溶液,微热,并把产生的气体通入酚酞试液,酚酞试液变成红色,说明该晶体是硫酸亚铁铵晶体;(三) ② (1)装配好实验装置后,先要检查装置的气密性;(2)加热前后及过程中均通入N2,停止加热后继续通N2的目的是防止倒吸和使生成的气体被相应装置完全吸收;
由关系式:FeSO4(NH4)2SO46H2O ~ 6H2O
392 108
可知39.2g的晶体分解的结晶水的质量为10.8g,所以①表格中x = 210.8; B装置中浓硫酸只能吸收NH3、SO3和H2O,故C装置只吸收二氧化硫,②最终生成SO2的质量为3.2g;由化学式可计算39.2g的晶体中硫元素的质量为6.4g,3.2g二氧化硫中硫元素的质量为1.6g,故三氧化硫中硫元素的质量为4.8g,最终生成SO3的质量为4.8g÷(32÷80×100%)=12g;39.2g的晶体中铁元素的质量为5.6g,反应后剩余固体总质量为:39.2g-28g-3.2g=8g,铁的氧化物中铁元素的质量分数为:5.6g÷8g×100%=80%,所以为氧化铁。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下图回答问题:
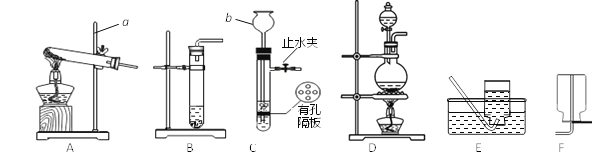
(1)仪器名称:a_______,b_______。
(2)用氯酸钾和二氧化锰制取O2,可选用装置A和______(选填装置序号)组合,反应的化学方程式为________。
(3)实验室制取氢气的化学方程式为_______,可选用发生装置C或______(选填装置序号);相对于另一装置,C具有的优点是________。
(4)用下图装置制取CO2并验证相关性质。
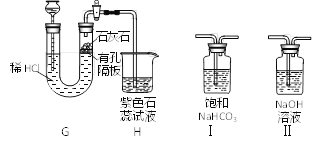
①生成CO2反应的化学方程式________。
②装置H中石蕊变红,甲同学得出CO2与H2O反应生成H2CO3的结论,乙同学提出质疑,理由是________。
③要消除以上质疑,可在装置G、H之间连接装置_________(选填“Ⅰ”或“Ⅱ”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为某些物质间的转化关系。A为常见化肥,E常作食品干燥剂,M只含3种元素。部分反应条件和生成物已略去。
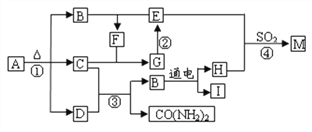
(1)化学式:A___________,F____________。
(2)反应①提醒在施用A时要注意__________。
(3)反应②的化学方程式:_______________。
(4)反应③中C和D的质量比为_________________。
(5)反应④符合“化学反应绿色化”(即原料中所有的原子全部转入期望的产品中),写出反应④的化学方程式________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用碳酸钡矿石(杂质不溶于水且不参加反应)制备BaCl2晶体的主要流程如下:
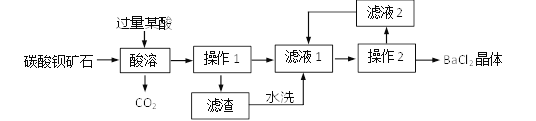
(1)某酸应选用______(选填序号)。
a.H2SO4 b.HCl c.HNO3
(2)证明某酸过量的方法:静置,向上层清液中滴加______溶液,产生气泡。
(3)操作1中,所用玻璃仪器有______、玻璃棒、烧杯。
(4)将滤渣水洗液和滤液2加入滤液1中的目的是_____(选填序号)。
a.提高原料的利用率 b.减少钡盐对环境的污染
-
科目: 来源: 题型:
查看答案和解析>>【题目】用下图1实验测定空气中O2的含量,最终钟罩内上升后的液面略低于刻度1,某同学对该现象作如下探究。
(一)钟罩内剩余气体探究
(猜测)结果偏小的原因可能是钟罩内O2或生成的CO2有剩余。
(实验1)该同学查阅资料得知:O2+4KI+4HCl=2I2+4KCl+2H2O,于是进行了如下图2实验:
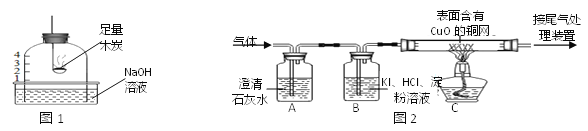
(1)A中观察到________,证明有CO2剩余。
(2)B中观察到_________,证明有O2剩余。
(3)C中观察到黑色固体变成红色,说明结果偏小的第三个原因可能是生成了不能被NaOH溶液吸收的__________(填化学式)气体。
(二)钟罩内溶液的成分探究
(资料)NaOH溶液与过量CO2反应会生成NaHCO3;Na2CO3受热不分解而NaHCO3受热易分解。
(猜测)该同学取一定量钟罩内溶液经低温蒸发、干燥等操作得到白色固体,作如下猜测:
白色固体可能是:①Na2CO3; ②NaHCO3; ③Na2CO3和NaHCO3。
(实验2)(4)取适量白色固体加热,产生CO2,则猜测_________(选填序号)不成立;
(5)取8.4g白色固体加入足量的稀盐酸中,充分反应后产生CO2的质量________(选填“<”、“=”或“>”)4.4g,则猜测③成立;
(6)该同学进一步查阅资料认为该固体可表示为:aNa2CO3bNaHCO3cH2O。称取该白色固体33.2 g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重4.5g;再通过碱石灰,碱石灰增重2.2g(假设气体均被完全吸收)。
(结论)a∶b ∶c=________。
(延伸)将该固体长期浸泡在NaOH溶液中,固体全部转化为Na2CO3,反应的化学方程式为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是
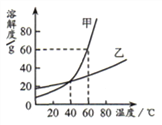
A. 甲物质中混有少量乙物质,采用蒸发结晶的方法提纯甲物质
B. 20℃时,甲物质的溶解度比乙物质的溶解度小
C. 40℃时,甲、乙两种物质的饱和溶液中溶质质量分数相等
D. 60℃时,将80g甲物质放入100g 水中,所得溶液中溶质与溶剂质量之比是4:5
-
科目: 来源: 题型:
查看答案和解析>>【题目】向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是
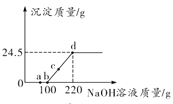
A. a点溶液中含有两种溶质
B. bc段发生反应的类型为置换反应
C. d点溶液中存在的离子为Na+、Cu2+、OH-、SO42-
D. 根据图中数据可以计算出氢氧化钠溶液的浓度
相关试题

