【题目】小明家的下水管道堵塞了,他从超市购买了一种名为“管道通”的药剂,打开包装后发现里面有灰色粉末和白色粉末各一袋,商品的部分标签如图1所示:

为了弄清这种“管道通”的化学成分和工作原理,小明进行了如下实验探究:
实验一:鉴别A、B粉末的成分,请你将下表补充完整。
实验操作 | 实验现象 | 实验结论 |
取少量灰色粉末于试管中,加入适量水, 振荡,用手触摸试管外壁 | 灰色粉末不溶解, 无明显现象 | 灰色粉末是铝粉 |
取少量白色粉末于试管中,加入适量水, 振荡,用手触摸试管外壁 | 白色粉末溶解, __________________ | 白色粉末是氢氧化钠 |
实验二:探究管道疏通的原理
【查阅资料】(1)下水管道里的淤积物主要为油污、食物残渣、毛发等;
(2)氢氧化钠是强碱,能去除油污、腐蚀毛发一类的东西,常用于疏通管道;
(3)铝能与氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和氢气,同时放出大量的热。偏铝酸钠(NaAlO2)是一种盐,易溶于水,溶液显碱性。写出铝与氢氧化钠溶液反应的化学方程式:______________。
【进行实验】小明用如图2示的玻璃弯管模拟家庭下水道,并用动物脂肪和毛发堵在弯管处,他按照使用说明依次加入铝粉、氢氧化钠和水,并用胶塞堵住弯管上口,观察到的现象是___________________,堵塞物体变软,落入废液杯中。
【交流拓展】为了确认实验二中的废液里否有氢氧化钠剩余,小明取少量废液于试管中,滴加几滴酚酞溶液,溶液变红,于是他得出结论:废液中有氢氧化钠剩余。你认为该结论______________(填“正确”或“不正确”),理由是____________________________。
参考答案:
【答案】 试管外壁发烫 2Al+2NaOH+2H2O ![]() 2NaAlO2+3H2↑ 弯管外壁发烫(或弯管内的温度明显升高)、产生大量气泡 不正确 偏铝酸钠溶液显碱性,也能使酚酞溶液变红
2NaAlO2+3H2↑ 弯管外壁发烫(或弯管内的温度明显升高)、产生大量气泡 不正确 偏铝酸钠溶液显碱性,也能使酚酞溶液变红
【解析】实验一:实验过程如下表所示:
操作 | 现象 | 结论 |
取少量灰色粉末于试管中,加入适量水, 振荡,用手触摸试管外壁 | 粉末不溶解,无明显现象 | 灰色粉末是铝粉 |
取少量白色粉末于试管中,加入适量水, 振荡,用手触摸试管外壁 | 粉末溶解,试管外壁发烫 | 白色粉末是氢氧化钠 |
实验二:(3)根据质量守恒定律可知,铝与氢氧化钠溶液反应的化学方程式是:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;【进行试验】小明用如图2示的玻璃弯管模拟家庭下水道,并用动物脂肪和毛发堵在弯管处,他按照使用说明依次加入铝粉、氢氧化钠和水,并用胶塞堵住弯管上口,观察到的现象是弯管内的温度明显升高,产生大量气体,堵塞物体变软被气体赶出,落入废液杯中;【交流拓展】这种方法不正确,理由是偏铝酸钠溶液显碱性,能使酚酞试液变红色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如下图所示,用“W”型玻璃管进行微型实验。下列说法正确的是_________

A.a处的实验现象为黑色固体粉末变为红色
B.b处的澄清石灰水变浑浊证明有CO2生成
C.a、b两处反应的基本类型分别是置换反应和复分解反应
D.该装置可利用____________的方法进行尾气处理
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,下列有关说法正确的是___________
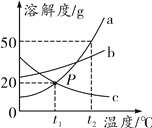
A.P点表示a和c的溶解度均为20 g
B.t2℃时,a饱和溶液的溶质质量分数为50%
C.从a和b的混合溶液中提纯a,可采用降温结晶的方法
D.将t1℃时a、b、c的饱和溶液升温到t2℃,所得溶液中溶质
的质量分数最大的为______
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅酸钠(Na2SiO3)是我国优先发展的精细化学产品。用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)。工业上制备硅酸钠晶体的流程如下:查阅资料:SiO2既不溶于水,也不与盐酸反应;Na2SO4、Na2CO3均易溶于水。请问答:
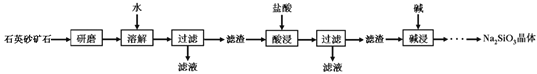
(1)“研磨”的目的是__________________________________;
(2)实验室的过滤操作中必须用到的玻璃仪器有:烧杯、漏斗、________,过滤时发现过滤速率缓慢,可能原因是______________________________;
(3)“酸浸”过程中发生反应的化学方程式为_________________________;
(4)“碱浸”时加入的碱液应选用_________________(填化学式)溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是某研究性学习小组设计的几种装置,请你分析并回答下列问题:
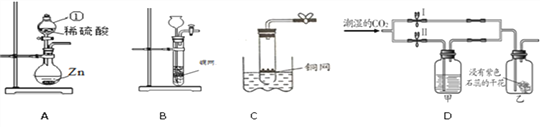
(1)图A中仪器①名称为________,发生反应的化学方程式为______________;
(2)用浓硫酸(溶质质量分数为98%,密度为1.84 g/mL)和水按照体积比为1︰10配制该实验所需的稀硫酸,所得稀硫酸的溶质质量分数约为________(保留到0.1%)。若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有______(填字母序号);
a.加少量水 b.加少量铁粉 c.加少量浓硫酸
(3)装置B是实验室常见的气体发生装置。源源同学从装置B得到启发,又用一支底部有一个小洞的试管和矿泉水瓶组合成装置C(夹持仪器都略去),用来制取二氧化碳,则C与B相比都具有的优点是__________,用装置B或C制取二氧化碳的化学反应方程式为___________;
(4)用装置D探究CO2的部分性质,若关闭Ⅱ阀,打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀,打开Ⅱ阀,紫色小花不变红,则甲瓶中所盛的试剂可能是______(填序号)。
①浓H2SO4 ②浓NaOH溶液 ③饱和NaCl溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组为探究CaCl2和HCl的混合溶液中CaCl2的质量分数,分别取40g混合溶液,依次加入一定量的Na2CO3溶液,观察到实验中既有气体又有沉淀生成,其中生成沉淀的化学方程式为:Na2CO3+CaCl2
 CaCO3↓+2NaCl;充分反应后,过滤、洗涤、干燥并称量,加入的Na2CO3溶液质量与所得沉淀质量关系如下表:
CaCO3↓+2NaCl;充分反应后,过滤、洗涤、干燥并称量,加入的Na2CO3溶液质量与所得沉淀质量关系如下表:实验序号
①
②
③
④
⑤
⑥
⑦
Na2CO3溶液质量/g
10
20
30
40
50
60
70
沉淀质量/g
m
0
1
2
3
4
4
(1)上表中m的值为_______;
(2)计算原混合溶液中CaCl2的质量分数________;
(3)第⑦次实验后所得溶液中的溶质是________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下面是对四个实验绘制的图形,其中实验结果与图形对应准确的是( )
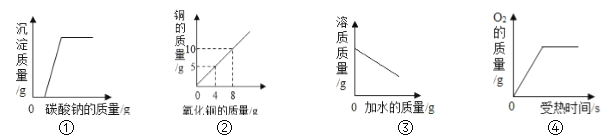
A. 图①是向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量
B. 图②是用 H2 还原 CuO 来测定 CuO 中铜元素的含量
C. 图③是向饱和的 KNO3 溶液中不断加水
D. 图④是用适量的KMnO4加热制O2
相关试题

