【题目】如图是a、b、c三种物质的溶解度曲线,下列有关说法正确的是___________
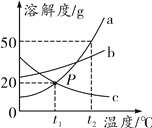
A.P点表示a和c的溶解度均为20 g
B.t2℃时,a饱和溶液的溶质质量分数为50%
C.从a和b的混合溶液中提纯a,可采用降温结晶的方法
D.将t1℃时a、b、c的饱和溶液升温到t2℃,所得溶液中溶质
的质量分数最大的为______
参考答案:
【答案】 C b
【解析】A、通过分析溶解度曲线可知,P点表示t1℃时a和c的溶解度均为20g,错误;
B、t2℃时,a物质的溶解度是50g,饱和溶液的溶质质量分数为: ![]() ,错误;C、a物质的溶解度受温度变化影响较大,a物质的溶解度随温度的升高而增大,c物质的溶解度随温度的升高而减小,所以从a和c的混和溶液中提纯a,可采用降温结晶的方法,正确;D、t1℃时,b物质的溶解度最大,a、c物质的溶解度相等,升高温度,a、b物质不会析出晶体,c物质会析出晶体,所以将t1℃时a、b、c的饱和溶液分别升温到t2℃,所得溶液中溶质的质量分数大小顺序为:b>a>c。
,错误;C、a物质的溶解度受温度变化影响较大,a物质的溶解度随温度的升高而增大,c物质的溶解度随温度的升高而减小,所以从a和c的混和溶液中提纯a,可采用降温结晶的方法,正确;D、t1℃时,b物质的溶解度最大,a、c物质的溶解度相等,升高温度,a、b物质不会析出晶体,c物质会析出晶体,所以将t1℃时a、b、c的饱和溶液分别升温到t2℃,所得溶液中溶质的质量分数大小顺序为:b>a>c。
故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~F是初中化学常见的物质,它们均含有同一种元素,其中B与E是植物光合作用的原料,E与F的组成元素相同,D可以用于改良酸性土壤。它们之间的转化关系如图所示(图中“→”表示物质间的转化关系,“—”表示两物质间能发生反应),请回答下列问题。
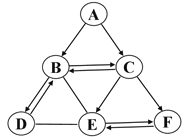
(1)物质F的化学式是_________;
(2)物质E的一种用途为___________________;
(3)A→C反应的化学方程式是_________________________;
(4)B→D的基本反应类型为________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)是一种新型吸波隐形材料中的增强剂。
(查阅资料)(1) MgCO3·nH2O微溶于水;
(2) MgCO3·nH2O在230℃时开始失去结晶水, 400℃以上时开始分解生成三种氧化物。
I.合成碳酸镁晶须
步骤:①配制一定溶度的MgSO4溶液和NH4HCO3溶液;②量取一定量的NH4HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;③用氨水调节溶液pH至9.5,放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品。
(1)步骤①配制一定溶质质量分数的MgSO4溶液所需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、______________;
(2)步骤②反应的温度控制在50℃,较好的加热方法是__________;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________;
(4)检验沉淀已洗涤干净的方法是:取最后一次洗涤的滤液,滴入_________,若无沉淀说明已洗涤干净。
(5)干燥得碳酸镁晶须产品温度不能过高,目的是______________。
II.测定产品MgCO3.nH2O中的n值
(方案一)将碳酸镁晶须放入A装置中加热(仪器和装置如下图所示),回答下列问题:
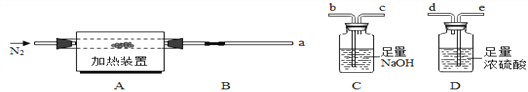
(6)上述装置的连接顺序为_____(按气流方向,用接口字母表示),其中B处的长玻璃导管的作用是__________,C装置的作用是__________。
(7)加热前先通入N2排尽装置中的空气,然后称取C、D的初始质量。再次连接好装置,边加热边通入N2,此时通入N2的作用是_____________。
(8)若B装置中无残留物。装置C反应前后质量差为m1,装置D反应前后质量差m2 。根据以上实验数据,确测定n值, n=___(用含m1、m2的代数式表示)。
(9)有同学提出上述连接好的装置仍不够完善。需要在D装置的后面连接下图装置,目的是________________,否则测得n值会________(“偏大”、“偏小”、“无影响”) 。
(方案二)
称量100g碳酸镁晶须放入如下图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液加入已知浓度的盐酸恰好完全反应,测得CO2的总量;重复上述操作2次。
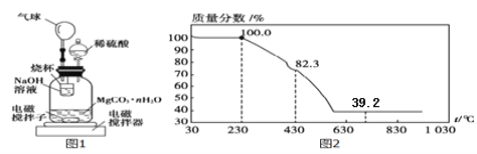
(10)氢氧化钠吸收二氧化碳的化学反应方程式____________________;
(11)图中气球的作用是__________________;
(12)上述反应后期要升温到30℃,主要目的是______________;
(13)设3次实验测得每100 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为ag,则n值为_______(用含a的代数式表示);
(14)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=_______(写出过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如下图所示,用“W”型玻璃管进行微型实验。下列说法正确的是_________

A.a处的实验现象为黑色固体粉末变为红色
B.b处的澄清石灰水变浑浊证明有CO2生成
C.a、b两处反应的基本类型分别是置换反应和复分解反应
D.该装置可利用____________的方法进行尾气处理
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅酸钠(Na2SiO3)是我国优先发展的精细化学产品。用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)。工业上制备硅酸钠晶体的流程如下:查阅资料:SiO2既不溶于水,也不与盐酸反应;Na2SO4、Na2CO3均易溶于水。请问答:
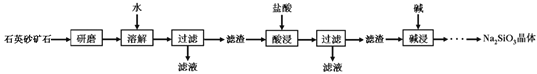
(1)“研磨”的目的是__________________________________;
(2)实验室的过滤操作中必须用到的玻璃仪器有:烧杯、漏斗、________,过滤时发现过滤速率缓慢,可能原因是______________________________;
(3)“酸浸”过程中发生反应的化学方程式为_________________________;
(4)“碱浸”时加入的碱液应选用_________________(填化学式)溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明家的下水管道堵塞了,他从超市购买了一种名为“管道通”的药剂,打开包装后发现里面有灰色粉末和白色粉末各一袋,商品的部分标签如图1所示:

为了弄清这种“管道通”的化学成分和工作原理,小明进行了如下实验探究:
实验一:鉴别A、B粉末的成分,请你将下表补充完整。
实验操作
实验现象
实验结论
取少量灰色粉末于试管中,加入适量水,
振荡,用手触摸试管外壁
灰色粉末不溶解,
无明显现象
灰色粉末是铝粉
取少量白色粉末于试管中,加入适量水,
振荡,用手触摸试管外壁
白色粉末溶解,
__________________
白色粉末是氢氧化钠
实验二:探究管道疏通的原理
【查阅资料】(1)下水管道里的淤积物主要为油污、食物残渣、毛发等;
(2)氢氧化钠是强碱,能去除油污、腐蚀毛发一类的东西,常用于疏通管道;
(3)铝能与氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和氢气,同时放出大量的热。偏铝酸钠(NaAlO2)是一种盐,易溶于水,溶液显碱性。写出铝与氢氧化钠溶液反应的化学方程式:______________。
【进行实验】小明用如图2示的玻璃弯管模拟家庭下水道,并用动物脂肪和毛发堵在弯管处,他按照使用说明依次加入铝粉、氢氧化钠和水,并用胶塞堵住弯管上口,观察到的现象是___________________,堵塞物体变软,落入废液杯中。
【交流拓展】为了确认实验二中的废液里否有氢氧化钠剩余,小明取少量废液于试管中,滴加几滴酚酞溶液,溶液变红,于是他得出结论:废液中有氢氧化钠剩余。你认为该结论______________(填“正确”或“不正确”),理由是____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是某研究性学习小组设计的几种装置,请你分析并回答下列问题:
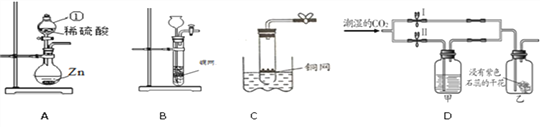
(1)图A中仪器①名称为________,发生反应的化学方程式为______________;
(2)用浓硫酸(溶质质量分数为98%,密度为1.84 g/mL)和水按照体积比为1︰10配制该实验所需的稀硫酸,所得稀硫酸的溶质质量分数约为________(保留到0.1%)。若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有______(填字母序号);
a.加少量水 b.加少量铁粉 c.加少量浓硫酸
(3)装置B是实验室常见的气体发生装置。源源同学从装置B得到启发,又用一支底部有一个小洞的试管和矿泉水瓶组合成装置C(夹持仪器都略去),用来制取二氧化碳,则C与B相比都具有的优点是__________,用装置B或C制取二氧化碳的化学反应方程式为___________;
(4)用装置D探究CO2的部分性质,若关闭Ⅱ阀,打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀,打开Ⅱ阀,紫色小花不变红,则甲瓶中所盛的试剂可能是______(填序号)。
①浓H2SO4 ②浓NaOH溶液 ③饱和NaCl溶液
相关试题

