【题目】用下列微型实验进行氧气、二氧化碳气体相关性质研究。
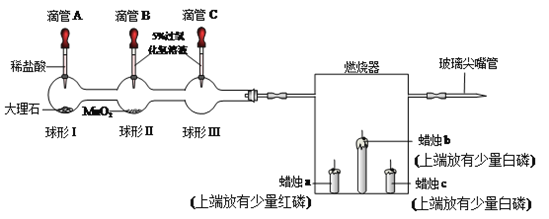
(1)同时挤压滴管B和C,控制相同液体量于球形容器中。
① 写出II反应的化学方程式________________________。
② 有关上述对比实验,说法正确的是__________(填写字母)。
A.MnO2加快反应速率 B.半分钟内球形III中产生气体少
C.反应过程中球形II比球形III内反应剧烈 D.MnO2一定分解产生气体
(2) 微热燃烧器,蜡烛b、c燃烧,蜡烛a不燃烧。写出白磷燃烧的化学方程式________。关于燃烧器中的实验分析正确的是_________(填写字母)。
A.探究可燃物燃烧需要温度达到着火点 B.探究可然物燃烧需要氧气
C.说明红磷与白磷是同素异形体 D.可以比较白磷、红磷着火点的高低
(3)挤压滴管A,将足量稀盐酸滴于球形I中,球形I中产生的现象为____________。一段时间后,蜡烛c熄灭,然后蜡烛b也熄灭了,其原因是_________________________。
(4)蜡烛熄灭后,将玻璃尖嘴管对着涂有澄清石灰水的小烧杯内,烧杯内壁变模糊,此现象 的化学方程式____________,此反应________(选填“能”或“不能”) 证明蜡烛一定含有碳元素。
(5)充分燃烧相同物质的量的碳和磷,消耗氧气物质的量之比为_____________。
参考答案:
【答案】 2H2O2![]() 2H2O+O2↑ ABC 4P+5O2
2H2O+O2↑ ABC 4P+5O2![]() 2P2O5 AD 产生大量气泡 密度比空气大,不可燃,不助燃 CO2+Ca(OH)2=CaCO3↓+H2O 不能 4:5
2P2O5 AD 产生大量气泡 密度比空气大,不可燃,不助燃 CO2+Ca(OH)2=CaCO3↓+H2O 不能 4:5
【解析】(1)①,过氧化氢在二氧化锰的催化作用下,生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;② A、MnO2在此反应中加快了过氧化氢的分解速率,正确; B、III中的过氧化氢分解较慢,半分钟内球形III中产生气体少,正确;C、二氧化锰加快了过氧化氢的分解速率,故反应过程中球形II比球形III内反应剧烈,正确; D、MnO2 只是加快过氧化氢的分解,本身质量和化学性质都不变,错误;白磷燃烧生成五氧化二磷,化学方程式为:4P+5O2
2H2O+O2↑;② A、MnO2在此反应中加快了过氧化氢的分解速率,正确; B、III中的过氧化氢分解较慢,半分钟内球形III中产生气体少,正确;C、二氧化锰加快了过氧化氢的分解速率,故反应过程中球形II比球形III内反应剧烈,正确; D、MnO2 只是加快过氧化氢的分解,本身质量和化学性质都不变,错误;白磷燃烧生成五氧化二磷,化学方程式为:4P+5O2![]() 2P2O5;燃烧器中的实验是探究可燃物燃烧需要温度达到着火点;可以比较白磷、红磷着火点的高低;(3)大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳气体,故挤压滴管A,将足量稀盐酸滴于球形I中,球形I中产生的现象为产生大量气泡,一段时间后,蜡烛c熄灭,然后蜡烛b也熄灭了,其原因是二氧化碳密度比空气大,不燃烧,也不支持燃烧;(4)蜡烛熄灭后,将玻璃尖嘴管对着涂有澄清石灰水的小烧杯内,烧杯内壁变模糊,是二氧化碳与澄清石灰水反应生成碳酸钙的缘故,此现象的化学方程式为:CaO+H2O
2P2O5;燃烧器中的实验是探究可燃物燃烧需要温度达到着火点;可以比较白磷、红磷着火点的高低;(3)大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳气体,故挤压滴管A,将足量稀盐酸滴于球形I中,球形I中产生的现象为产生大量气泡,一段时间后,蜡烛c熄灭,然后蜡烛b也熄灭了,其原因是二氧化碳密度比空气大,不燃烧,也不支持燃烧;(4)蜡烛熄灭后,将玻璃尖嘴管对着涂有澄清石灰水的小烧杯内,烧杯内壁变模糊,是二氧化碳与澄清石灰水反应生成碳酸钙的缘故,此现象的化学方程式为:CaO+H2O![]() Ca(OH)2,此反应不能证明蜡烛一定含有碳元素,因为空气中也含有一定量的二氧化碳;
Ca(OH)2,此反应不能证明蜡烛一定含有碳元素,因为空气中也含有一定量的二氧化碳;
(5)C+O2![]() CO2,P+
CO2,P+![]() O2
O2![]()
![]() P2O5
P2O5
1mol 2mol 1mol ![]() mol
mol
故充分燃烧相同物质的量的碳和磷,消耗氧气物质的量之比为4:5。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)下表是CO2气体在水中的几组溶解度数据(单位:mL/100mL水)
溶解度 温度(℃)
大气压
0
25
50
75
100
1
1.79
0.752
0.423
0.307
0.231
10
15.92
7.14
4.095
2.99
2.28
25
29.30
16.20
9.71
6.82
5.73
①根据CO2的溶解度表,可以得出气体的溶解度随外界条件的变化规律是:__________、____。
②打开可乐瓶有气体逸出,说明原瓶中的压强_________(填“>”、“<”或“=”)瓶外大气压强。
(2)甲、乙两物质(均不含结晶水)的溶解度曲线如下图,请回答
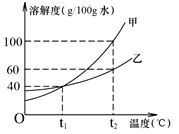
① t2℃时,甲、乙两物质溶解度较大的是___________。
② t1℃时,50g水中加入30g乙,充分溶解所得溶液的质量是___________g。
③ t2℃时,将乙的不饱和溶液转化为饱和溶液一定可行的方法 是___________(填编号)。
A.加足量溶质乙 B.蒸发溶剂至晶体析出 C.降温
④ t2℃时,甲、乙溶液的溶质质量分数相等且均为a%,则甲溶液一定为__________(填“饱和”或“不饱和”)溶液,a%的取值范围为___________。
⑤ 将t2℃等质量的甲、乙饱和溶液分别降温到t1℃,有关说法正确的是___________。
A.t1℃时溶质质量:甲=乙 B.t1℃时溶剂质量:甲>乙
C.t1℃时溶液质量:甲<乙 D.析出晶体质量:甲>乙
-
科目: 来源: 题型:
查看答案和解析>>【题目】用下列装置对碳及其氧化物的性质进行系列实验探究。

实验
物质
问 题
X
Y
实验一
CO
CuO
(1)实验开始前先通CO一段时间赶尽装置内空气。通过________________现象,可知装置内充满了CO气体。
(2)写出A处反应的化学方程式_________________,其中氧化铜发生_________(选填“氧化”或“还原”)反应。
(3)C中实验现象__________________。
(4)该实验能证明CO的化学性质是___________。
实验二
CO2
C
写出A处反应的化学方程式________________,通过__________________现象,能证明该反应发生。
(2)B装置的作用是_______________。
(3)若2molC完全反应完,需要消耗________CO2。
I.1mol II. 2mol III. >2mol IV.无法判断
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室常用的气体制取装置如下,请回答。
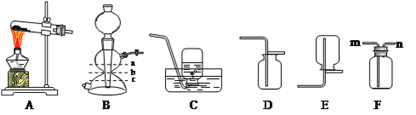
⑴装置B的名称是___________。若选用A装置制氧气,反应的化学方程式为_______________,收集纯净的氧气选择装置__________(填编号)。
⑵实验室制CO2常选B作为发生装置,选择依据为_________________。实验时打开玻璃活塞后,可观察到的现象为___________________。若用F装置收集CO2,气体从______(填“m”或“n”)端通入,验满的方法为__________。集满一瓶CO2气体后,关闭玻璃活塞,待反 应完全停止后,容器中的液面位置为_________(填“a”、“b”或“c”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组对石灰石进行煅烧,并对煅烧后固体成分进行探究。
(1)写出此反应的化学方程式_______________________。
(2)根据化学方程式进行猜想。固体残留物成分:
I. 只有氧化钙;II. 只有碳酸钙;III. _____________
(3)甲乙丙三位同学分别设计了三种方案探究煅烧后固体成分。
友情提示:①CaO+2HCl→CaCl2+H2O;
②Ca(OH)2+2HCl→CaCl2+2H2O
③氯化钙溶液呈中性。
方案设计
操作及现象
实验结论
解释
方案一

固体物质中
一定含有_______
用化学方程式解释判断理由_______。
方案二

乙同学得出
猜想II成立
该同学设计方案是否合理,理由是______。
方案三
 (丙同学在一支试管中完成探究。)
(丙同学在一支试管中完成探究。)猜想III成立
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学利用石灰石和稀盐酸进行如下实验,操作过程和数据如图(样品中杂质不与酸反应也不溶于水)。
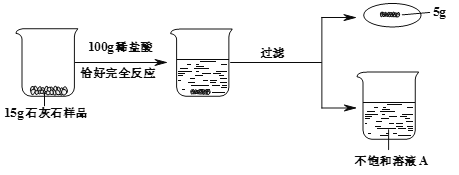
(1)15g石灰石样品中CaCO3物质的量。
(2)列式计算不饱和溶液A的溶质质量分数(结果准确到0.1%)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作正确的是 ( )
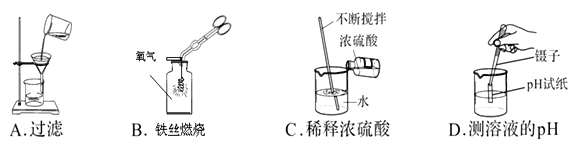
A. A B. B C. C D. D
相关试题

