【题目】(7分)某研究性学习小组到超市买了一包碱面,包装袋上标明主要成分是碳酸钠,还含有少量的氯化钠。该兴趣小组为研究其成分,称取样品25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为14.6%的稀盐酸,反应生成二氧化碳的质量与所加入的稀盐酸质量关系如图。试回答下列问题:
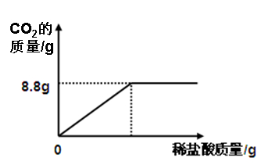
(1)样品充分反应后生成CO2的质量为 g
(2)原固体中Na2CO3的质量分数是多少?(请写出计算过程)
(3)样品中碳酸钠与盐酸恰好完全反应时,消耗的稀盐酸的质量是_____________g
【交流反思】研究性学习小组的甲同学认为,要求出碳酸钠的质量,还可以使用与盐酸所属类别不同的其他物质,如________、 ______(填一种具体物质的化学式及该物质所属的类别)的溶液与样品反应,测定相关物质的质量,进行有关计算即可。
参考答案:
【答案】(1) 8.8 g(2)84.8%(3)100g【交流反思】CaCl2 , 盐
【解析】
试题分析:设:样品中碳酸钠的质量为x ,需要盐酸的质量为Y
Na2CO3 + 2HCl == 2NaCl + CO2 ↑ + H2O
106 73 44
x Y 8.8g
列比例式得:106:X=44:8.8克 解得:X=21.2克,同理解得Y=14.6克
则该纯碱样品中碳酸钠的质量分数为21.2g/25.0g × 100% == 84.8%
样品中碳酸钠与盐酸恰好完全反应时,消耗的稀盐酸的质量是=14.6/14.6%=100克
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)物质之间是相互联系的,现有硫酸铜、氢氧化钠、铁、盐酸、氧化铁、二氧化碳六种物质,它们之间相互可以发生一些化学反应。请回答下列问题:
(1)分类是学习和研究物质及其变化的一种常用方法。分类要有一定的标准,按照物质的组成对六种物质进行分类,请将属于下列分类结果的物质的化学式填写在下面的虚线框内
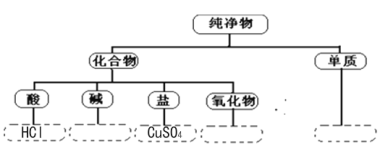
(2)从上述物质中选择满足下列要求的反应
①若两种物质反应能产生蓝色沉淀,则其反应的化学方程式为: 。
②写出一个有气体生成的置换反应的化学反应方程式: 。
③为了证明上述物质中的酸与碱发生了化学反应,可以选取一种试剂进行验证。验证方法是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)元素周期表是学习化学的重要工具,下表是元素周期表中1-18号元素的原子核外电子排布。
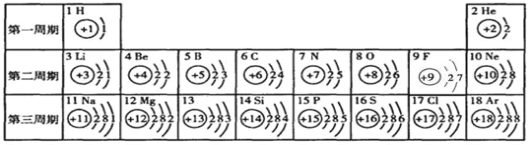
(1)13号元素的符号是 ;
(2)11号元素的原子在化学反应中较容易 (选填“得”或“失”)电子,该元素属于 元素(选填“金属”或“非金属”);
(3)列举8号元素对应单质的一种用途 ;
(4)由金属活动顺序表可知,K 、Ca、Mg三种金属失电子能力由强到弱的顺序为:K 〉Ca 〉Mg,如图是三种原子的结构示意图,据此推测金属失电子能力的强弱除与最外层电子数有关外,还可能与 有关。
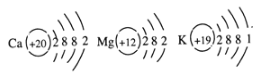
-
科目: 来源: 题型:
查看答案和解析>>【题目】20℃时,氯化钠的溶解度为36g.对这句话的理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100︰36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液是该温度时氯化钠的饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关物质粒子或图示的叙述正确的是
A.在化学变化中,原子的核电荷数和核外电子数都不发生改变
B.未见饭菜就闻到饭菜的香味,说明物质的分子很小,且在不停地运动
C.某粒子示意图
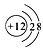 ,表示的是一种金属原子
,表示的是一种金属原子D.组成H2O、CH4、H2等物质中的氢元素,其原子核内质子数都为
-
科目: 来源: 题型:
查看答案和解析>>【题目】20℃时,氯化钠的溶解度为36g,对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)我市拥有丰富的海洋资源,开发利用这些宝贵的资源有力地促进了我市经济的发展。海水的成份主要含有NaCl、MgCl2、Na2SO4、CaCl2等物质,经过蒸发结晶得粗盐,剩余的液体为母液.图中操作1为蒸发结晶,操作2为过滤,试剂A是一种改良酸性土壤常用的碱.如图所示以海水为原料可获得许多化工产品:

(1)工业生产中在母液中添加试剂A的化学式为
(2)在实验室中进行过滤时,所需要的玻璃仪器有烧杯、 和玻璃棒,其中玻璃棒的作用是
(3)步骤②发生反应的化学方程式是
(4)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 ,此反应能够发生是因为Cl2的活动性比Br2的 (选填“强”或“弱”)
相关试题

