【题目】根据题目要求填空。
(1)洁净的空气对于人类非常重要,下列做法不利于保护大气的是(________)
A.使用洁净能源 B.节日燃放烟花 C.植树造林 D.取消公交车,多开私家车
(2)为了保护大气,2011年11月在我国新颁布的《环境空气质量标准》中,基本监控项目增设了可吸入颗粒物的浓度限值,与该监测项目有关的是___。
A.二氧化氮 B.一氧化碳 C.PM2.5 D.臭氧
(3)现有下列物质:A.过氧化氢;B.铜;C.澄清石灰水;D.液态空气;E.高锰酸钾;F.稀有气体;G.铁丝;H浮在水面上的冰;请在以下空格中填写上述有关物质的序号:
①属于化合物的是______;②属于混合物的是______; ③属于含氧化合物,但不属于氧化物的是______.
(4)完成下列符号的书写:
A.空气中含量第二的元素和地壳中含量最高的金属元素组成的化学式______
B.相对分子质量最小的气体的化学式_____
C.电子数为10的原子团离子______
D.既能表示某种元素,又能表示某种物质的符号_____
(5)元素周期表是学习研究化学的重要工具.下表是1~18号元素的部分最高正化合价和最低负化合价规律信息:
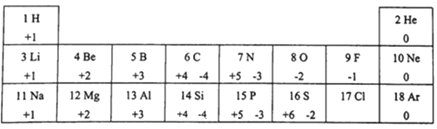
请分析信息并回答下列问题:
①12号元素属于______元素(填“金属”或“非金属”),它的离子与______(写元素符号)原子具有相同的核外电子数.
②推断17号元素最高正化合价为____,其最低负化合价与Si形成化合物的化学式为____.
(6)利用物质沸点不同可以实现混合物的分离,根据下表数据判断。
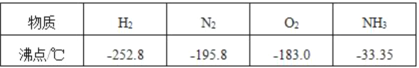
要将工业合成氨的产物氨气(NH3)从它的反应物氮气和氢气的混合物中分离开来,最适宜的温度应该控制在___℃<T<___℃,该过程属于_______(填物理/化学)变化。
(7)烟道气体脱硫可以有效地治理燃煤带来的环境污染。脱硫方法有多种,世界普遍使用的是钙法,所占比例在90%以上。某钙法脱硫工艺的主要反应是:
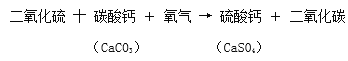
其中碳酸钙在自然界中主要存在于大理石、石灰岩和贝壳等物质中。
①上述反应涉及的物质中,属于单质的是_______(写名称)。
②在将SO2转化为CaSO4的过程中,硫元素的化合价____(填“升高”、“降低”或“不变”)。
③该脱硫工艺的优点是______。
(8)水是生命之源,也是人类最宝贵的资源。用你学过的化学知识回答下列问题:
①自然界中的水都不是纯水,净水时需加入明矾的目的是___________ 。
②欲除去水中不溶性杂质,需进行过滤操作,该操作过程中玻璃棒所起的作用是______。
③某同学在完成电解水实验时,发现正极产生了10 mL气体,则负极产生的气体体积是 ____。该实验能够说明水是由氢元素与氧元素组成的理论依据是 ___。
参考答案:
【答案】BD C AEH CDF E Al2O3 H2 OH- He 金属 Ne +7 SiCl4 -195.8 -33.35 物理 氧气 升高 能消除有害气体,不生成新的污染物;原料易得,成本低 吸附沉降 引流 20mL 化学反应前后元素种类不变
【解析】
(1)A、使用洁净能源可以减少污染物的排放,有利于保护大气;B、燃放烟花会生成有害气体和粉尘,不利于保护大气;C、植树造林会净化空气,有利于保护大气;D、取消公交车,多开私家车,易造成空气污染,不有利于保护大气;
(2)与PM2.5项目监测项目有关的是可吸入颗粒物;
(3)①由两种或两种以上的元素组成的纯净物叫化合物,过氧化氢、高锰酸钾、在水面上的冰都属于化合物;②混合物是由两种或两种以上的物质组成,澄清石灰水、液态空气、稀有气体都属于混合物;③氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,高锰酸钾属于含氧化合物,但不是氧化物;
(3)A、空气中含量第二的元素是氧元素,地壳中含量最高的金属元素是铝元素,二者组成的物质的化学式为Al2O3;
B、相对分子质量最小的气体是氢气,化学式:H2;
C、电子数为10的原子团离子是氢氧根离子,符号为:OH-;
D、既能表示某种元素,又能表示某种物质的可以是氦气,符号为:He;
(5)①12号元素是镁元素,属于金属元素;镁原子核外电子排布情况为2、8、2结构,在化学反应中易失去最外层的2个电子,形成2、8结构,与氖原子结构相同;
②17号元素是氯元素,核外有17个电子,最高价与最外层电子数相同,即+7价,最低价为-1价,硅元素显+4价,形成的化合物的化学式为SiCl4;
(6)氨气、氮气、氢气的沸点分别为-33.35℃、-195.8℃、-252℃,要将工业合成氨的产物氨气(NH3)从它的反应物氮气和氢气的混合物中分离开来,应该采取剩余氨气,也就是让氨气不气化,最适宜的温度应该控制在-195.8~-33.35℃.该过程中没有新物质生成,属于物理变化;
(7)①二氧化硫(SO2)+碳酸钙+氧气→硫酸钙(CaSO4)+二氧化碳,属于单质的是氧气;
②烟道气体脱硫中的“硫”指的是硫元素;②SO2中硫元素的化合价为+4价,CaSO4中硫元素的化合价+6价;将SO2转化为CaSO4的过程中,硫元素的化合价升高;
③该脱硫工艺的优点是能消除有害气体,不生成新的污染物;原料易得,成本低;
(8)①由于明矾溶于水生成的胶状物具有吸附性,所以,自然界中的水都不是纯水,净水时需加入明矾的目的是吸附沉降;
②欲除去水中不溶性杂质,需进行过滤操作,该操作过程中玻璃棒所起的作用是引流;
③某同学在完成电解水实验时,正负极的气体之比为1:2,发现正极产生了10mL气体,则负极产生的气体体积是20mL;该实验能够说明水是由氢元素与氧元素组成的理论依据是化学反应前后元素种类不变。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是三个实验示意图,根据下图所发生的化学反应现象及化学反应原理进行总结归纳,并回答下列问题:


实验一 碳的燃烧 实验二 铁丝的燃烧
(1)写出仪器①的名称:____________。
(2)写出实验一木炭燃烧的文字表达式并写出化学式_______________________________。
(3)实验二为某同学延长反应现象设计的铁丝燃烧实验,实验现象是铁丝剧烈燃烧、放出大量的热、_______________,集气瓶底放一层水的目的是_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】半期复习阶段,小李同学梳理了以下知识:
①用醋可以除去水壶上的水垢;②某粒子的结构示意图为
 ;该粒子一定是氖原子;
;该粒子一定是氖原子;③将浓氨水加入滴有酚酞的蒸馏水中,观察到溶液由无色变成红色;
④自制简易净水器中的活性炭能起过滤作用;
⑤为检验二氧化碳,应将燃着的木条伸入集气瓶中;
⑥滴瓶上的滴管使用过后不需清洗,直接放回原瓶.
其中正确的是( )
A. ①②③④⑥ B. ②③④⑤ C. ①④⑤ D. ①③⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业酒精中含有甲醇,下图是甲醇的分子结构模型,下列叙述正确的是
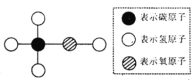
A. 甲醇是由1个碳原子、4个氢原子和1个氧原子构成的
B. 甲醇中碳、氢元素的质量比为1:2
C. 1个甲醇分子中有28个电子
D. 甲醇完全燃烧时生成CO2 和H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学实验是学习化学的基础,请根据下列装置图回答问题
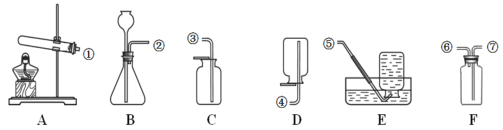
(1)实验室用双氧水和二氧化锰制取氧气时,反应符号表达式 ________。可选用的发生装置是(填字母代号,下同)______,若需要控制反应速率,可将图中_______(填仪器名称)替换掉。收集较纯净的氧气,可选择_______收集装置。
(2)F装置若从管⑥通入氧气进行收集,则所采用的收集方法叫做__________(填“向上排空法”或“向下排空法”或“排水法”);排空法收集氢气时,氢气应从管________通入。若要使用装满氧气的集气瓶F,则水从_____进。
(3)按如图所示,将带火星的木条分别插入盛满氧气的集气瓶中,观察到木条复燃,且在①中燃烧比在②中旺。以上实验现象说明了氧气的性质:①_______;②______。
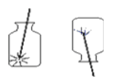
(4)收集一瓶氧气用于实验室完成细铁丝燃烧的实验,若未看到明显现象,可能原因是_________,若看到了明显的现象,该现象可能是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣小组同学们在课外活动中设计了以下实验研究某混合气体的组成。
(已知:二氧化碳易被氢氧化钠溶液吸收)
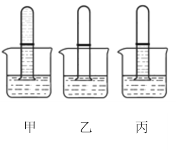
(1)第一组:取三支试管,在其容积的二分之一处做标记。分别充满气体(甲为CO2,乙为A气体,丙为CO2和A的混合气)后倒扣在NaOH溶液中。最终观察到的实验现象如图所示(压强差忽略不计)。据此推测:气体A的化学性质有__________。
(2)第二组:同学们利用下图所示的装置进行实验。
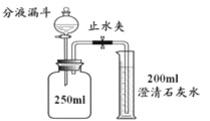
实验步骤:关闭止水夹,向充满丙的集气瓶中注入10 mlNaOH溶液(足量),充分反应后,冷却至室温,打开止水夹。观察到的实验现象是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙、丁、戊是5种常见物质,由氢、氧、硫、钙4种元素中的1一3种组成。
(l)甲是无色有刺激性气味的气体,也是空气污染物之一,则甲的化学式是_______。
(2)乙是一种无色液体,将人体呼出的气体吹入乙中出现浑浊现象,则液体乙是____。
(3)丙在一定条件下发生反应的微观示意图如下,在方框中补全相应微粒的图示________。
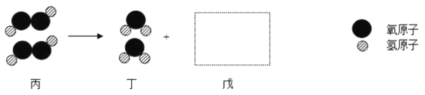
(4)丁在一定条件下反应生成戊,该反应的文字表达式为_________。
(5)下列说法正确的是______(填字母序号)。
A.甲、丁、戊都是氧化物
B.甲、丙 、戊中都含有氧分子
C.丁和戊在一定条件下可以相互转化
D.(3)和(4)中发生的反应都是分解反应
相关试题

