【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)初步探究:Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含________________;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有______ |
取上层清液,滴加_____ | ________ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是________(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)深入探究:在老师的指导下同学们取原固体,进行如下实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_______;其中,操作X的名称是______,无色滤液中一定含有的阳离子是____________。
参考答案:
【答案】 CuSO4 Na2CO3 酚酞试液(或含有铜离子、铁离子、铵根离子的盐溶液) 溶液不变红(或不产生蓝色沉淀或红褐色沉淀或刺激性气味气体) 除尽碳酸钠溶液 B CaCO3 BaSO4 过滤 Na+
【解析】(一)定性探究:Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,结合硫酸铜溶液为蓝色,故原固体中一定不含CuSO4;
Ⅱ.由于氯化钙溶液与Na2CO3反应生成白色沉淀,所以原固体中一定含有碳酸钠;过量的氯化钙将碳酸钠除去,验证氢氧化钠的存在,取上层清液,滴加酚酞试液(或含有铜离子、铁离子、铵根离子的盐溶液),出现溶液不变红(或不产生蓝色沉淀或红褐色沉淀或刺激性气味气体)等现象,说明原固体中不含NaOH;其中,步骤①加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是除尽碳酸钠,防止对氢氧化钠的检验造成干扰;
Ⅲ.再取Ⅰ中得到的滤液少量,考虑滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成,故“原固体中一定含有NaCl”的结论不正确;
(二)定量探究:根据“沉淀全部溶解”的现象可确定白色沉淀的成分是CaCO3,则原固体中一定不含 BaSO4;其中,操作X将固体和液体分离,所以是过滤,通过(一)中分析,原固体中一定含有碳酸钠、氯化钙,不含氢氧化钠、硫酸铜、硫酸钡,所以当原固体加水后,无色滤液中一定含有的阳离子是Na+。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下图所示的实验装置图填空。
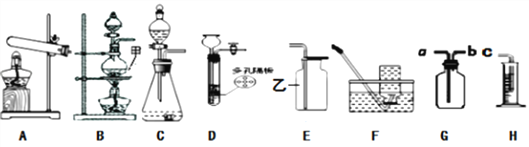
(1)B装置中甲的仪器名称为______;E装置中乙的仪器名称为___________。
(2)实验室用C装置制取氧气时,发生反应的化学方程式为___________。
(3)现有大理石、碳酸钠粉末、稀盐酸、稀硫酸,选择合适的物质用D装置制取CO2气体,其化学方程式为______________,用在反应过程中,使反应停止的操作是_________,收集二氧化碳一般用装置___________。
(4)小明同学用锌粒和稀盐酸制取氢气,小华认为小明制取的氢气不纯,杂质气体除了水蒸气外还含有_______(填化学式),使用_________(填名称)溶液除去,若用装置G和H收集并测定氢气的体积,将G装置改装的方法是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~G是初中化学常见的7种物质,分别由C、H、O、Cl、Ca中的一种或几种元素组成。已知A、B、C、D、E是不同类别的物质,G是可燃性气体,D的固体可用于人工降雨。这些物质之间相互关系如图所示,图中?°—?±表示能相互反应,“ →”表示转化关系。(部分反应物、生成物及反应条件已略去)。
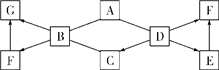
(1)写出D、F的化学式:D________,F________。
(2)写出E的一种用途:__________________。
(3)B到G的基本反应类型是________________。
(4)写出一个由A转化为C的化学方程式:______________________。
-
科目: 来源: 题型:
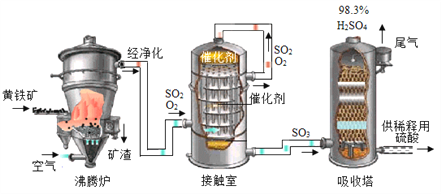
查看答案和解析>>【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。现以黄铁矿为原料生产硫酸,工艺流程如图所示
(查阅资料)

(1) 接触室中发生反应的化学方程式为________________。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是________g,稀释时,应将______沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,请写出稀硫酸的一种用途____________。
(2) 依据生产硫酸的工艺流程图,下列说法正确的是_____________(填字母).
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.SO2可作为生产硫酸的原料再利用 D.沸腾炉排出的矿渣可供炼铁.
(3) 化学兴趣活动小组称取1.6g黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,最终B锥形瓶中增重1.28g.
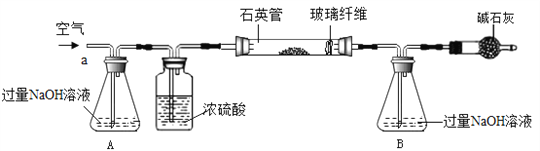
①A中NaOH溶液的作用____________________________。
②计算该黄铁矿中FeS2的质量分数___________。(假设每步反应均完全)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙两种固体物质的溶解度曲线。下列说法中错误的是( )
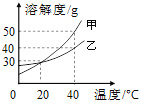
A. 20℃时,甲、乙饱和溶液中溶质质量分数相等
B. 40℃时,甲的溶解度大于乙的溶解度
C. 40℃时,乙的饱和溶液中溶质的质量分数为40%
D. 将40℃甲的饱和溶液降温到20℃,会有晶体析出
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定质量的CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法错误的是( )
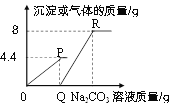
A. P点时的溶液只含一种溶质
B. R点对应横坐标的数值为180
C. 0至P过程中溶液的pH变大
D. Q至R段表示生成沉淀的过程
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定量的硝酸铜、硝酸银的混合溶液中加入5.6 g铁粉,充分反应后过滤、洗涤、干燥,称得固体14 g。向固体中加入稀盐酸,无气泡产生,则下列分析正确的是( )
A. 滤液中一定不含有硝酸银 B. 滤液中一定含有硝酸铜
C. 滤出的固体中含有银7.6g D. 滤出的固体中含有铜6.4g
相关试题

