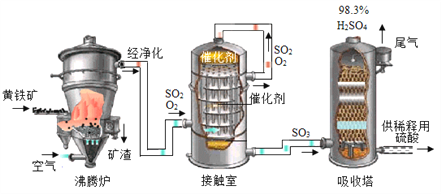
【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。现以黄铁矿为原料生产硫酸,工艺流程如图所示
(查阅资料)![]()
(1) 接触室中发生反应的化学方程式为________________。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是________g,稀释时,应将______沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,请写出稀硫酸的一种用途____________。
(2) 依据生产硫酸的工艺流程图,下列说法正确的是_____________(填字母).
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.SO2可作为生产硫酸的原料再利用 D.沸腾炉排出的矿渣可供炼铁.
(3) 化学兴趣活动小组称取1.6g黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,最终B锥形瓶中增重1.28g.
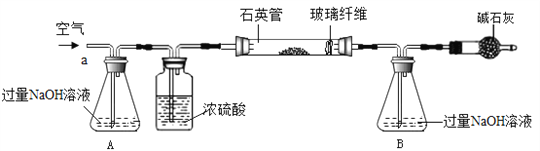
①A中NaOH溶液的作用____________________________。
②计算该黄铁矿中FeS2的质量分数___________。(假设每步反应均完全)
参考答案:
【答案】 2SO2+O2![]() 2SO3 880 浓硫酸 除铁锈、精炼石油等 ACD 除去进入装置内空气中的CO2 75%
2SO3 880 浓硫酸 除铁锈、精炼石油等 ACD 除去进入装置内空气中的CO2 75%
【解析】根据所学知识和题中信息知,(1) 接触室中发生反应的化学方程式为2SO2+O2![]() 2SO3。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是∶100g×98%=10%×﹙100g+x﹚,x=880g。稀释时,应将浓硫酸沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,稀硫酸的一种用途是除铁锈、精炼石油等。(2)由题中信息知,A、为使黄铁矿充分燃烧,需将其粉碎,增大反应的接触面积,故A正确;B、催化剂能够提高SO2的反应速率,但不会提高产量,故B错误;C、SO2可作为生产硫酸的原料再利用,既环保,又节约了资源,故C正确;D、沸腾炉排出的矿渣可供炼铁,矿渣中含有铁元素,故D正确。(3) ①A中NaOH溶液的作用是除去进入装置内空气中的CO2,CO2与NaOH溶液反应生成碳酸钠。②根据质量守恒定律知生成二氧化硫质量是1.28g。解∶设黄铁矿中FeS2的质量分数为x
2SO3。现将100g98%浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是∶100g×98%=10%×﹙100g+x﹚,x=880g。稀释时,应将浓硫酸沿烧杯内壁慢慢注入烧杯内液体中,并用玻璃棒不断搅拌。硫酸是一种重要的化工产,用途十分广泛,稀硫酸的一种用途是除铁锈、精炼石油等。(2)由题中信息知,A、为使黄铁矿充分燃烧,需将其粉碎,增大反应的接触面积,故A正确;B、催化剂能够提高SO2的反应速率,但不会提高产量,故B错误;C、SO2可作为生产硫酸的原料再利用,既环保,又节约了资源,故C正确;D、沸腾炉排出的矿渣可供炼铁,矿渣中含有铁元素,故D正确。(3) ①A中NaOH溶液的作用是除去进入装置内空气中的CO2,CO2与NaOH溶液反应生成碳酸钠。②根据质量守恒定律知生成二氧化硫质量是1.28g。解∶设黄铁矿中FeS2的质量分数为x
4FeS2 +11O2 ![]() 2Fe2O3 +8SO2
2Fe2O3 +8SO2
480 512
1.6g×x 1.28g
![]() =
=![]() ,x=75%。
,x=75%。
答∶①A中NaOH溶液的作用是除去进入装置内空气中的CO2。②该黄铁矿中FeS2的质量分数是75%。
点睛∶浓硫酸密度比水大,稀释,放热,一定要把浓硫酸倒入水中。硫酸是一种重要的化工产,用途十分广泛,稀硫酸的一种用途是除铁锈、精炼石油等。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:

(1)上表中X的数值为_________;
(2)计算原固体混合物样品中氯化镁的质量分数是_______?(请依据相关化学方程式进行计算,写出必要的过程)
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入______克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E分别表示初中化学常见的五种物质,它们的部分反应和转化关系如图所示。( “
 ”表示两种物质间能发生反应,“
”表示两种物质间能发生反应,“ ”表示一种物质能够转化为另一种物质,部分反应物或生成物以及反应条件已略去,不考虑微溶物)。C是盐,D是氧化物。
”表示一种物质能够转化为另一种物质,部分反应物或生成物以及反应条件已略去,不考虑微溶物)。C是盐,D是氧化物。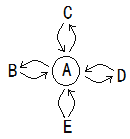
(1) 常温下,若A为一种气态氧化物,且A与B的相互转化能实现自然界中的碳氧循环, C可用于制玻璃,俗称纯碱,E是单质。A的固体俗称_____,C的化学式为__,D的用途_______(只说一点)。A转化为B的化学方程式_______。
(2) 若A为生活中使用最广泛的金属,且E不能转化为A,其它关系不变,C由两种元素组成,其溶液为浅绿色,E是无色溶液,与A、C反应时都能产生明显现象,D是黑色固体,B是一种气体单质,B与D可以反应生成A和水。
① 写出A
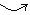 D的化学方程式:____________。
D的化学方程式:____________。② B与D的反应属于_____________________ (填基本反应类型)
③ E 中溶质的化学式为_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为某医用葡萄糖注射液商标的一部分,下列说法不正确的是

A. 该葡萄糖注射液的溶质质量分数为5%
B. 100mL该葡萄糖注射液中溶质为5g
C. 在人体组织里,葡萄糖在酶的作用下经缓慢氧化转变成CO2 和H2O
D. 葡萄糖中碳元素、氢元素、氧元素的质量之比为1:2:1
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组对中和反应进行探究,请你参与实验
(探究活动1)证明酸和碱发生了反应小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是_______;反应的化学方程式________;玻璃棒的作用是_____。
(探究活动2)能否通过证明有水生成来证明其反应的发生?
(设计实验)小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验。
(小资料)a.变色硅胶吸水后由蓝色变为红色;
b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的目的是____________________;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是____________________;
(3)上述三支试管中能证明酸和碱反应有水生成的现象是_______________;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤
实验现象
实验结论
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜
_______
氢氧化钠和盐酸发生了反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学用语填空:
①2个氢原子:____________; ②铁离子:____________;
③氧化镁中的镁为+2价:_________; ④一个氮气分子:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在点燃条件下,甲和乙反应生成丙和丁,反应前后分子变化的微观示意图如下,下列说法不正确的是
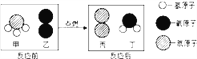
A. 甲和乙反应的质量比为17:32
B. 该反应的基本类型为置换反应
C. 丁是人体中含量最多的物质
D. 生成物丙和丁两种物质的分子个数比为1:3
相关试题

