【题目】Ⅰ.某同学研究亚硫酸钠(化学式为Na2SO3)热分解反应时,作了两种假设:
假设一:它按CaCO3受热方式来分解。
假设二:它按KClO3受热分解方式来分解。
①假设一对应的化学方程式是____________。确认假设二是否成立的简单实验操作是_________。
②该同学将取一定质量的样品置于坩埚中充分灼烧,发现最终得到固体质量较原样品质量增加了大约12.7%。据此他认为___________(选填编号)。
A.假设一成立 B. 假设二成立 C. 两种假设均不成立
固体质量增加可能的原因是_________________。
③在查阅资料后,该同学再次进行了实验。他将一定质量样品置于密闭真空容器中充分加热,最终得到固体质量与原样品相同。但进一步分析表明,该固体组成为两种新的钠盐,其微粒个数之比为1:3,请写出相应的化学方程式:_________________________。
④该同学想要进一步探究次氯酸钠(化学式NaClO)的分解反应。他查阅资料后,得知NaClO有多种热分解方式(每种分解方式的产物仅有两种)。若其中一种产物为NaCl,则另一种产物可能是:_____(选填编号)。
A.Cl2 B. O2 C. Na2O D. NaClO3
Ⅱ.已知A—H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且C能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据右图所示的转化关系(图中 反应条件均已略去),请回答:
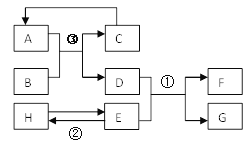
(1)写出下列物质的化学式: B___________、C ___________;
(2)写出下列反应的化学方程式:① _________________; ③(_______________),反应②的基本反应类型是___________。
参考答案:
【答案】 Na2SO3![]() Na2O + SO2↑ 将带火星的木条伸到试管口,观察木条是否复燃 C Na2SO3 与氧气(或空气中的物质)反应生成固体物质 4 Na2SO3
Na2O + SO2↑ 将带火星的木条伸到试管口,观察木条是否复燃 C Na2SO3 与氧气(或空气中的物质)反应生成固体物质 4 Na2SO3![]() Na2S + 3 Na2SO4 B D Fe2O3 CO2 Fe + CuSO4 == Cu + FeSO4 3CO + Fe2O3
Na2S + 3 Na2SO4 B D Fe2O3 CO2 Fe + CuSO4 == Cu + FeSO4 3CO + Fe2O3![]() 3CO2 + 2Fe 复分解反应
3CO2 + 2Fe 复分解反应
【解析】Ⅰ①假设它按CaCO3受热方式来分解,则生成硫化钠和二氧化硫;假设它按KClO3受热分解方式来分解则有氧气生成,据此分析解答;②根据质量守恒定律分析解答;③根据亚硫酸钠受热分解生成硫化钠和硫酸钠解答;④根据分解的化学方程式解答;ⅡA、C是组成元素相同的气体,且C能产生温室效应,则C为二氧化碳,C为一氧化碳。B为红棕色,是赤铁矿的主要成分,则B是氧化铁。一氧化碳与氧化铁反应生成铁和二氧化碳,则D是铁。F是紫红色金属;H是蓝色沉淀,则F是铜,H是氢氧化铜。铁与硫酸铜溶液反应生成铜和硫酸亚铁。则E是硫酸铜,G是硫酸亚铁。硫酸铜溶液与碱反应生成氢氧化铜沉淀和水。Ⅰ①假设它按CaCO3受热方式来分解,则生成硫化钠和二氧化硫,反应的化学方程式为Na2SO3![]() Na2O + SO2↑;假设它按KClO3受热分解方式来分解则有氧气生成。故确认假设二是否成立的简单实验操作是将带火星的木条伸到试管口,观察木条是否复燃;②参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。由于该反应是分解反应,根据质量守恒定律可知,反应后物质的质量不应该增加,因此两种假设均不成立,故选C;③亚硫酸钠受热分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3
Na2O + SO2↑;假设它按KClO3受热分解方式来分解则有氧气生成。故确认假设二是否成立的简单实验操作是将带火星的木条伸到试管口,观察木条是否复燃;②参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。由于该反应是分解反应,根据质量守恒定律可知,反应后物质的质量不应该增加,因此两种假设均不成立,故选C;③亚硫酸钠受热分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3![]() Na2S + 3Na2SO4;④次氯酸钠溶液受热分解的化学方程式3NaClO
Na2S + 3Na2SO4;④次氯酸钠溶液受热分解的化学方程式3NaClO![]() NaClO3+2NaCl,干燥后继续加热2NaClO3
NaClO3+2NaCl,干燥后继续加热2NaClO3![]() 2NaCl+3O2↑,故选BD;Ⅱ(1)由分析知B为氧化铁,化学式为Fe2O3;C为二氧化碳,化学式为CO2;(2)写出下列反应的化学方程式:①铁与硫酸铜溶液反应生成铜和硫酸亚铁,反应的化学方程式为Fe + CuSO4 = Cu + FeSO4;③一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应的化学方程式为3CO + Fe2O3
2NaCl+3O2↑,故选BD;Ⅱ(1)由分析知B为氧化铁,化学式为Fe2O3;C为二氧化碳,化学式为CO2;(2)写出下列反应的化学方程式:①铁与硫酸铜溶液反应生成铜和硫酸亚铁,反应的化学方程式为Fe + CuSO4 = Cu + FeSO4;③一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应的化学方程式为3CO + Fe2O3![]() 3CO2 + 2Fe;反应②是硫酸铜溶液与碱反应生成氢氧化铜沉淀和水,该反应属于复分解反应。
3CO2 + 2Fe;反应②是硫酸铜溶液与碱反应生成氢氧化铜沉淀和水,该反应属于复分解反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.C60发现使人类了解到一个全新的碳世界,根据图1回答下列问题:
① C60属于______(填“单质”或“化合物”)
② C60这种物质是由______(填“分子”或“原子”)构成
③ C60与金刚石、石墨具有相似的______(填“化学”或“物理”)性质
④ 足球可由橡胶制成,橡胶属于______(填“有机”或“无机”)物.
Ⅱ. 铁是生活中最常见的金属,根据图回答下列问题:

①不粘锅利用了铁的______(填“导电”或“导热”)性.
②不粘锅手柄应选择______(填“热塑”或“热固”)性塑料制作
③鸡蛋清提供的营养素主要是______(填答案字母)
A.糖类 B.油脂 C.蛋白质 D.维生素
④上图聚四氯乙烯内衬还能防止铁锅生锈,其原因是______.
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
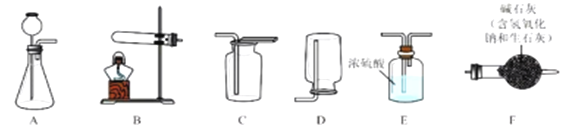
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固)
 CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。II.NaHCO3制备
物质
NaHCO3
NH4Cl
溶解度/g(20℃)
9.6
37.2
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.高炉炼铁所需的原料有铁矿石、焦炭、石灰石等,其过程可用下图简要表示:
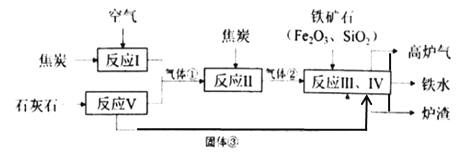
已知气体①、气体②和固体③均属于氧化物。
(1)气体②的化学式为______。根据氧化物的性质推测炉渣的主要成分为________(填化学式)。
(2)炼铁高炉底部通过不同高度的出口分离铁水与炉渣(如下图所示)。能实现渣铁分离的原因是因为炉渣具有_______________、____________的性质。

(3)反应Ⅰ~Ⅴ中属于化合反应的有___个,属于分解反应的有________个,属于置换反应的有_____个。
(4)高炉气中含有多种成分,其中含量最高(占55~60%)的是___(填化学式),此外还含有25~30%的可燃性气体_____(填化学式),以及9~12%左右的_____(填化学式)。
Ⅱ.有一包固体粉末,可能由CuSO4、CaCO3、Na2SO4中的一种或几种所组成.小文为了确定它的成分进行了如下实验:

(1)操作a的名称是______(填“蒸发”或“过滤”),其中必须要用到的玻璃仪器有烧杯、玻璃棒和________。
(2)写出蓝色沉淀的化学式:_________。
(3)白色固体是________,写出实验室检验CO2的化学方程式______________________。
(4)小文通过实验后认为,这包固体粉末中只有两种物质,他的判断是__________(填“正确”或“错误”)的,理由是________________________________。
-
科目: 来源: 题型:
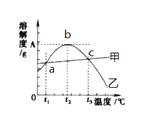
查看答案和解析>>【题目】图1是甲、乙两种物质的溶解度曲线。20℃时,向两支试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到图2所示的现象。下列说法正确的是
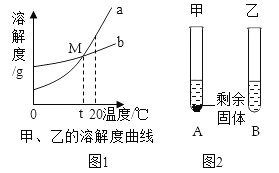
A. 20℃时,乙溶液是饱和溶液
B. t℃后某一温度时,乙溶解度大于甲的溶解度
C. 升高温度可使两试管中甲、乙溶液的质量分数均增大
D. 从20℃降低到t℃时,甲、乙两物质的溶解度相等,溶质质量分数甲溶液比乙溶液小
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在学习酸的化学性质后,做了甲、乙二个实验,实验结束后,把甲乙试管中的废液依次缓慢倒入同一洁净的废液缸中,下列对废液缸中废液成分的分析正确的是
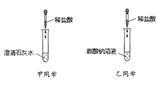
A. 废液中除氯化钠外,一定有氯化钙
B. 如果废液呈碱性,则一定有氢氧化钙
C. 如果废液呈酸性,则一定有氯化钙、氯化钠
D. 废液中一定有氯化钠,还有氢氧化钙或碳酸钠或盐酸中的一种物质
-
科目: 来源: 题型:
查看答案和解析>>【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃
20
30
40
60
80
90
100
溶解度
(g/100GH20)
NaCl
36.0
36.3
36.6
37.3
38.4
39.0
39.8
MgSO4
33.7
38.9
44.5
54.6
55.8
52.9
50.4
请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
相关试题

