【题目】某同学对CaH2的制备和性质进行探究。
【阅读资料】①用H2与钙加热制得CaH2 ②钙遇水立即发生剧烈反应生成一种碱和一种气体 ③CaH2要密封保存,遇水反应也生成一种碱和一种气体
【CaH2的制备】设计的制取装置如图所示.
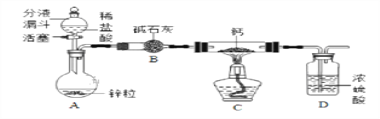
(1)装置B的作用是____________________________;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显__________色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是________________________。
【CaH2的性质探究】取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为_________(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因___________________
【实验验证】
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ____________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________________ | 猜想三成立 |
【定量分析】
取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为__________(写出计算过程).
参考答案:
【答案】 吸收水蒸气 蓝色 可能是钙和水反应 H2 Na2CO3+Ca(OH)2= CaCO3+2NaOH 无明显现象 过一会儿有气泡产生 84%
【解析】本题在对CaH2的制备和性质进行探究的情境下考查了获取信息的能力,反应后物质的成分,酸、碱、盐的性质和化学综合计算,综合性较强。首先分析题目中所给的信息,然后结合学过的知识对信息加以整合,依据题意分析问题、解决问题。
CaH2的制备:(1)阅读信息资料中钙与氢气反应时必须是干燥的氢气,氢化钙不能与水接触,所以装置B的作用是吸收水蒸气;
(2)氢化钙和水反应会生成碱,碱能使石蕊变蓝色,所以在溶液中滴入石蕊试液后显蓝色;钙和水反应也会生成碱,实验中不能确定确有氢化钙生成;
CaH2的性质探究:(1)点燃产生的气体,火焰淡蓝色,说明气体具有可燃性,将燃烧产物通入澄清石灰水中,无现象,说明产物不是二氧化碳,该气体不含碳元素,根据质量守恒定律该气体为H2;
(2)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以猜想四不合理,化学方程式为:Na2CO3+Ca(OH)2= CaCO3+2NaOH;
实验验证:碳酸盐和钙离子接触会生成沉淀,酸和碳酸盐反应会生成二氧化碳气体,NaOH、Na2CO3的混合物中加入盐酸时,盐酸先消耗氢氧化钠,氢氧化钠完全消耗后,再消耗碳酸钠,所以混合物中加入盐酸后开始不产生气泡,过一会儿有气泡产生。因此:
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | 无明显现象 | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | 过一会儿有气泡产生 | 猜想三成立 |
【定量分析】设参加反应的氢化钙质量为x,依据元素守恒可知,氢化钙和水反应生成氢氧化钙和氢气,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以
CaH2→Ca(OH)2→CaCO3
42 100
x 2g
![]() x=0.84g
x=0.84g
样品中CaH2的质量分数![]() ×100%=84%。
×100%=84%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过分析下列实验或现象,可以得出相应的结论,其中不合理的是( )
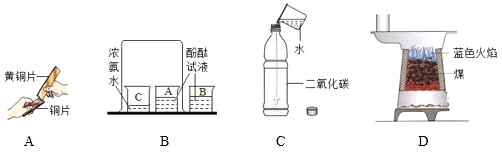
A. 实验中黄铜片能在铜片上刻画出痕迹,说明黄铜的硬度比铜片大
B. 实验既可以说明分子在不停地运动着,又可以说明氨水显碱性
C. 实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性
D. 图中煤炉里煤炭上方燃烧产生的蓝色火焰说明一氧化碳具有可燃性
-
科目: 来源: 题型:
查看答案和解析>>【题目】材料是人类赖以生存和发展的重要物质,铜是目前使用最广泛的金属之一。
(一)铜材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是________。
(2)纯铜又称紫铜,常见铜合金有黄铜、青铜等种类。家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹。
① 以上叙述中不涉及到的材料是_______(选填序号)。
A.金属材料 B.无机非金属材料 C.有机合成材料
② 我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_______。
③ 鉴别黄铜和黄金,以下方法不可行的是______(选填序号)。
A.观察颜色 B.加稀盐酸 C.在空气中灼烧
(二)铜及其化合物的实验
I.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法。
(1)方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色。
①反应中溶液的PH逐渐_________(填“增大”或“减小”)。
②该反应的化学方程式_________。
(2)方案2:将铜片加入浓硫酸中,加热,产生刺激性气味,溶液逐渐变成蓝色。将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是________。
(3)从环保角度进行比较,你认为方案_______(填“1”或“2”)更合理。
Ⅱ.在一定量硫酸铜溶液中加入碳酸钠溶液,过滤、洗涤、低温干燥得到碱式碳酸铜固体,其组成为:xCuCO3·yCu(OH)2·zH2O。能证明固体已洗净的方法为__________。
(三)碱式碳酸铜的热分解实验
兴趣小组称取此固体12.0g,在科研人员的指导下用下图装置进行热分解实验。

【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物。该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近。
(1)装置A的作用是___________。
(2)加热前后及过程中均通入空气,加热后通空气的目的是________。
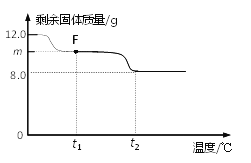
(3)控制温度在不同的范围对B中样品加热。测得装置C、D的质量在实验前后的变化情况如下表所示,测得B中剩余固体质量随温度的变化如下图所示。
装置
实验前/g
实验后/g
C
198.0
199.8
D
221.0
223.2
①图中F点对应的m=__________。
② 根据提供的数据, xCuCO3·yCu(OH)2·zH2O中x ﹕y ﹕z = _________。
③ 若缺少装置E,测得的________(选填“x”、“y”、“z”)的值会偏大。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象关系合理的是( )
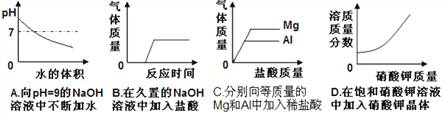
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】
(题文)
用化学用语填空:
(1)碘酒中的溶剂:______________
(2)汽水中能使紫色石蕊试剂变红的物质______________;
(3)表示出氯化亚铁中铁元素的化合价:__________;
(4)2个铵根离子______________。
(5)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂。高铁酸钾受热时发生的反应为4K2FeO4
 2R+4K2O+3O2↑,R是________(填化学式)
2R+4K2O+3O2↑,R是________(填化学式) -
科目: 来源: 题型:
查看答案和解析>>【题目】将宏观、微观及化学符号联系在一起是化学学科的特点。
(1)A、B、C、D表示四种物质,其微观示意图如图所示:
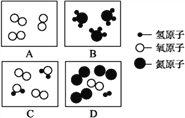
①从微观角度看,B图表示:_____ (填化学符号);
②图中表示混合物的是____ (填字母序号)。
(2)如图是甲和乙在一定条件下反应生成丙和丁的微观示意图,请根据图示回答问题。
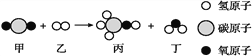
①丙的化学式为_______ ②甲乙反应的分子个数比为______
-
科目: 来源: 题型:
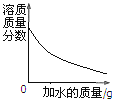
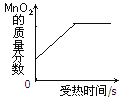
查看答案和解析>>【题目】下列四个坐标图分别表示四个实验过程中某些量的变化,其中不正确的是( )


过氧化氢
溶液分解
B.向盐酸和氯化钙的混合溶液中滴加
碳酸钠溶液
C.在一定温度下,向有氯化钠固体的氯化钠溶液中加入水搅拌
D.给氯酸钾和二氧化锰的混合物加热
A. A B. B C. C D. D
相关试题

