【题目】某研究性学习小组为了测定黄铜(铜、锌合金)的组成。在化学老师的帮助下,选用98%的浓硫酸、黄铜样品进行下列实验和计算。
实验Ⅰ:配制150g 9.8%的稀硫酸。
(1)计算:需要浓硫酸的质量____________g,约8.2mL。
(2)量取:用量筒准确量取所需的浓硫酸和水。
(3)混匀:稀释时一定要将____________沿器壁慢慢注入____________里,并不断搅拌。
(4)装瓶贴标签:请填写下侧的标签。____________

实验Ⅱ:测定黄铜样品中铜的质量分数。称取黄铜样品10g,向其中逐滴加入9.8%的
稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。

试计算:
样品中铜的质量分数。(计算结果精确到小数点后一位)______(在答题卡上写出计算过程)
参考答案:
【答案】 15 浓硫酸 水 硫酸溶液 9.8% 解:设黄铜样品中锌的质量为X。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
X 0.1g
65:2= X: 0.1g
X=3.25g
黄铜样品中铜的质量分数为(10g-3.25g)/10g ×100%=67.5%
答:黄铜样品中铜的质量分数为67.5%。
【解析】实验Ⅰ:(1)根据根据溶液配制前后溶质质量不变解答;
(3)根据浓硫酸稀释的操作步骤(酸入水、沿杯壁、缓慢倒、不断搅)分析;
(4)根据标签的填写要求分析;
实验Ⅱ:根据相关反应分析解答。
解:实验Ⅰ:(1)设需要浓硫酸的质量为x。98%x=150g×9.8% x=15g;
(3)混匀:稀释时一定要将浓硫酸沿器壁慢慢注入水里,并不断搅拌;
(4)装瓶贴标签:标签内容包括名称、溶质质量分数。故填硫酸溶液 9.8%;
实验Ⅱ:由图示可知生成氢气的质量为0.1g,根据氢气的质量算出锌的质量,再算出铜的质量,最后计算质量分数。
设黄铜样品中锌的质量为X。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
x 0.1g
![]()
x=3.25g
黄铜样品中铜的质量分数为![]() =67.5%
=67.5%
答:黄铜样品中铜的质量分数为67.5%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年福建省泉州市】下列做法能减少环境污染的是
A.燃放烟花爆竹 B.大力发展煤炭火力发电
C.垃圾分类处理 D.生活污水直接排入河流
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,回答有关问题。
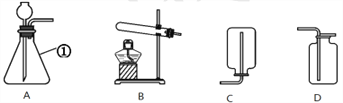
(1)图中标有①的仪器名称是_____________。
(2)实验室制取二氧化碳的化学方程式是__________________________________, 收集二氧化碳时,证明集气瓶已充满二氧化碳的方法是_______________________________________,集满二氧化碳的集气瓶应_____________(填“正”或“倒”)放在桌面上。
(3)实验室加热氯酸钾和二氧化锰制取氧气的化学方程式是_______________________________________,其中二氧化锰起_____________作用, 应选择的发生装置是_____________(填字母) 。
(4) 49g 稀硫酸与足量锌反应生成 0.2g 氢气,该稀硫酸的溶质质量分数是多少_____________?
(写出解题过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016届北京市石景山区九年级(下)第10周周考】“创建国家卫生城市,建设美好健康兴化”是我们共同的责任,下列做法不利于保护环境的是( )
A.实行垃圾分类回收再利用 B.对污水进行综合治理
C.在汽车上安装尾气净化装置 D.鼓励购买轿车,限制公共交通的发展
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C 、D、E、F分别是由两种或三种元素组成的常见化合物。B是人类利用最广泛的一种氧化物,生活中可用来灭火;D广泛用于玻璃、造纸、纺织、洗涤剂的生产;人体胃酸中含有F,可帮助消化。它们之间的一部分关系如图所示,(图中“ — ”表示两端的物质能发生化学反应;“ →”表示物质间存在转化关系。部分反应物或生成物已略去)请回答下列问题:

(1)B物质的化学式为____________;F物质的化学式为____________。
(2)D → E反应的化学反应方程式为 ________________________。
(3)A → C反应的化学反应方程式为 ________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
(1)在C60、金刚石、硫酸铜三种物质中,由离子构成的物质是________。
(2)从微观角度解释下列问题:
①一氧化碳和二氧化碳化学性质不同的原因是____________________。
②金刚石和石墨物理性质差异很大的原因是______________________。
(3)核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:
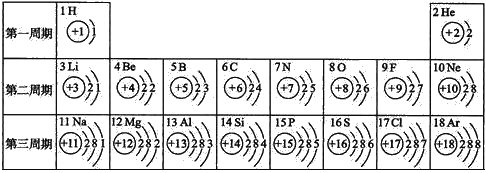
①同一族的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是____________(填字母序号)。
A.C和Ne B.Be和He C.Al和Si D.F和Cl
②画出镁离子结构示意图________________。
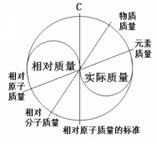
(4)太极图体现了对立和统一,对称和对应的关系,与初中化学的某些核心观念不谋而合。右图是某同学制作的化学质量观太极图。图中C处应填写的是____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)某同学设计如下图所示实验,探究二氧化碳的有关性质。
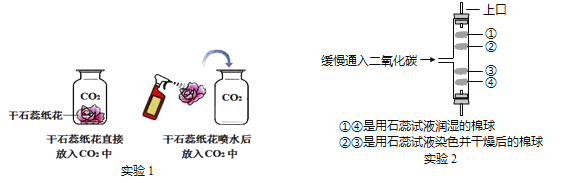
请填空:
①实验1采用了科学探究中的控制变量法,该实验控制的变量是____________。
②实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是____________________,该反应的化学方程式是________________________。
③实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第____________(填序号)号棉球先变色。
(2)研究发现燃烧排放的气体中,CO2浓度(用体积分数表示)越高,越容易被收集。 与传统的燃料燃烧方式相比,化学链燃烧具有排放CO2浓度更高,易于收集的优点。下图为利用镍元素(Ni)进行化学链燃烧的原理示意图。
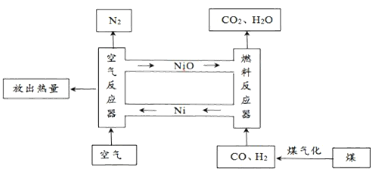
①空气反应器中,金属镍与氧气在一定条件下发生燃烧的化学方程式为__________________。
②燃料反应器中发生的部分化 反应如下:
Ⅰ.H2 + NiO
 Ni+H2O Ⅱ.CO + NiO
Ni+H2O Ⅱ.CO + NiO  Ni+CO2
Ni+CO2 其中属于置换反应的是________________(选填“Ⅰ”或“Ⅱ”)。
③与CO、H2直接在空气中燃烧相比,化学链燃烧从燃料反应器排放出的CO2浓度更高的原因是________________________。
相关试题

