【题目】下表是元素周期表中第2、3周期元素,请回答有关问题.
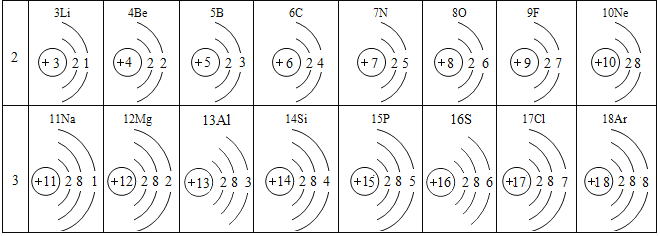
![]() 下列各组具有相似化学性质的元素是______
下列各组具有相似化学性质的元素是______![]() 填字母序号
填字母序号![]() .
.
A、Na、Cl B、O、S C、F、Ne D、C、Ar
![]() 写出一条第三周期元素原子的核外电子排布规律:______.
写出一条第三周期元素原子的核外电子排布规律:______.
![]() 第7号元素与第12号元素的原子形成化合物的化学式为______.
第7号元素与第12号元素的原子形成化合物的化学式为______.
![]() 某粒子的结构示意图为
某粒子的结构示意图为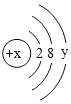 ,当
,当![]() ,该粒子的符号为______.
,该粒子的符号为______.
![]() 利用上表中给出的元素,写出下列含有氮元素的化学式各一个,并标出所写化学式中氮元素的化合价;氮单质______,氮的氧化物______.
利用上表中给出的元素,写出下列含有氮元素的化学式各一个,并标出所写化学式中氮元素的化合价;氮单质______,氮的氧化物______.
参考答案:
【答案】 B 同一周期的元素的原子,核外电子层数相同、同一周期元素的原子,从左至右最外层电子数依次增大等 Mg3N2 S2- N2 NO
【解析】(1)最外层电子数相同,化学性质相似,其中O和S的最外层电子数都为6,所以化学性质相似;(2)在元素周期表中,处于同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大(合理即可),故填:同一周期的元素的原子,核外电子层数相同;同一周期元素的原子,从左至右最外层电子数依次增大等;(3)7号是氮元素,常显-3价,12号是镁元素,常显+2价,二者组成的化合物是氮化镁,其化学式为Mg3N2;(4)由题意知X-Y=8,故X=8+Y;在原子中X=2+8+Y,故由此可知,图中微粒为离子,即Y=8,故X=8+8=16,因此该微粒为硫离子,符号为:S2-;(5)由氮元素组成的单质是氮气;氮的氧化物较多,如一氧化氮、二氧化氮、三氧化二氮、五氧化二氮等;故符号为:N2、NO(答案合理即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学符号和数字表示:
 两个铁离子______;
两个铁离子______; 硝酸银中银元素的化合价______;
硝酸银中银元素的化合价______; 铝制品在空气中表面失去金属光泽所形成的物质______
铝制品在空气中表面失去金属光泽所形成的物质______ 构成氯化钠的微粒:______;
构成氯化钠的微粒:______; 海水中含量最多的金属元素与非金属元素组成的化合物:______;
海水中含量最多的金属元素与非金属元素组成的化合物:______; -
科目: 来源: 题型:
查看答案和解析>>【题目】结合水和溶液的相关知识,回答下列问题:
 对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度较高的是______。
对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度较高的是______。 水是化学实验中常用的试剂,下列各组物质能用水鉴别的是______
水是化学实验中常用的试剂,下列各组物质能用水鉴别的是______ 填字母
填字母 。
。A.氢氧化钠和硝酸铵
 食盐和蔗糖
食盐和蔗糖  高锰酸钾和碘
高锰酸钾和碘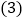 欲配制100g溶质质量分数为
欲配制100g溶质质量分数为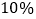 的氯化钠溶液,完成此实验的正确操作顺序是______。
的氯化钠溶液,完成此实验的正确操作顺序是______。 溶解
溶解  把配好的溶液装入细口瓶
把配好的溶液装入细口瓶  称量
称量  计算
计算  量取
量取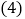 如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
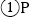 点的含义是______。
点的含义是______。 在
在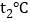 时,向30克a物质中加入50克水,充分溶解后所得溶液的质量是______克。
时,向30克a物质中加入50克水,充分溶解后所得溶液的质量是______克。 将
将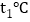 时a、b、c三种物质的饱和溶液升温至
时a、b、c三种物质的饱和溶液升温至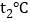 ,所得溶液中溶质质量分数大小关系是______。
,所得溶液中溶质质量分数大小关系是______。 物质中含有少量c物质,可用______方法提纯a物质
物质中含有少量c物质,可用______方法提纯a物质 填“降温结晶”或“蒸发结晶”
填“降温结晶”或“蒸发结晶” 。
。 -
科目: 来源: 题型:
查看答案和解析>>【题目】水是一切生物生存所必需的,我们应该了解有关水的一些知识。
 为了防止水的污染,下列做法有利于保护水资源的是______
为了防止水的污染,下列做法有利于保护水资源的是______ 填编号
填编号 ;
; 抑制水中所有动、植物的生长
抑制水中所有动、植物的生长 不任意排放工业废水
不任意排放工业废水 大量使用化肥农药
大量使用化肥农药 生活污水净化处理后再排放
生活污水净化处理后再排放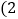 在化学实验和科学研究中,水也是一种常用的试剂。极少部分水分子在特定条件下容易解离而得到
在化学实验和科学研究中,水也是一种常用的试剂。极少部分水分子在特定条件下容易解离而得到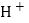 和
和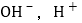 易与水分子形成水合氢离子
易与水分子形成水合氢离子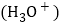 ,与水分子相比,下列对水合氢离子描述不合理的是______
,与水分子相比,下列对水合氢离子描述不合理的是______ 填字母序号
填字母序号 ;
;A.氧元素的化合价发生了改变
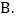 微粒的构成发生了改变
微粒的构成发生了改变C.微粒的化学性质发生了改变
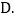 微粒的电子数发生了改变
微粒的电子数发生了改变 溶液在生产和生活中有广泛的应用。某同学配制溶液时,在用量筒量取所需水的过程中,他俯视读数,这样配制得到的溶液溶质质量分数会______
溶液在生产和生活中有广泛的应用。某同学配制溶液时,在用量筒量取所需水的过程中,他俯视读数,这样配制得到的溶液溶质质量分数会______ 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响” 。
。 -
科目: 来源: 题型:
查看答案和解析>>【题目】根据如图所示的实验装置图回答:

(1)写出编号的仪器名称:① ;② 。
(2)实验室用高锰酸钾制取氧气,应选择的发生装置是 (填序号),该反应的化学方程式为 。排水法收集完氧气后,应先 再 ,目的是 。
(3)实验室用石灰石和稀盐酸反应制取CO2,应选用的收集装置是 (填序号),该反应的化学方程式为 ,仪器①的下端必须伸入反应物液面以下形成“液封”,其原因是 。
(4)如图F所示装置可用来测量生成CO2的体积,其中在水面上放一层植物油的目的是 ;
(5)图G和图B都可用作实验室用锌粒和稀硫酸反应制取氢气的发生装置,G装置与B装置比较,G装置除了节约药品优点外,还有操作上的优点是 。
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氧气(化学式:NH3)。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。制取并收集NH3,应该从图中选择的发生装置是 (填序号),收集装置是 (填序号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
【提出问题】
 白色沉淀A是什么?
白色沉淀A是什么?(2)无色滤液B中的溶质有哪些?
【查阅资料】腌制皮蛋的原料配方是少量NaCl、CaO和过量
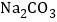 的固体混合物。
的固体混合物。【理论推理】
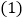 白色沉淀A是
白色沉淀A是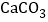 ,请写出生成该沉淀的化学方程式______。
,请写出生成该沉淀的化学方程式______。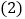 滤液B中含有
滤液B中含有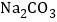 、NaOH、NaCl三种溶质。
、NaOH、NaCl三种溶质。【实验验证】为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤
实验操作
实验现象
实验结论
I
取少量滤液B于试管中,加入过量的
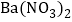 溶液,过滤
溶液,过滤______
滤液B中含有
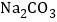 、NaOH、NaCl
、NaOH、NaClII
取少量步骤I中所得滤液于试管中,加入酚酞溶液
______
III
另取少量步骤I中所得滤液于试管中,先加入足量的稀硝酸,再加入 ______ 溶液
产生白色沉淀
【拓展提升】
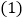 向步骤I中加入过量
向步骤I中加入过量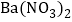 溶液的目的是______。
溶液的目的是______。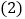 小妮同学认为若将步骤I中的
小妮同学认为若将步骤I中的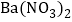 溶液换为
溶液换为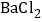 溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______
溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______ 填“合理”或“不合理”
填“合理”或“不合理”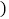 。
。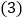 小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的
小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的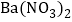 溶液,也能得出滤液B的溶质中含有
溶液,也能得出滤液B的溶质中含有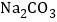 和NaOH的结论,你是否同意他的观点并说明理由______。
和NaOH的结论,你是否同意他的观点并说明理由______。 -
科目: 来源: 题型:
查看答案和解析>>【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量
剩余固体的质量
第一次加入10g
3.0g
第二次加入10g
2.0g
第三次加入10g
1.0g
第四次加入10g
0.6g
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)
相关试题

