【题目】根据如图所示的实验装置图回答:

(1)写出编号的仪器名称:① ;② 。
(2)实验室用高锰酸钾制取氧气,应选择的发生装置是 (填序号),该反应的化学方程式为 。排水法收集完氧气后,应先 再 ,目的是 。
(3)实验室用石灰石和稀盐酸反应制取CO2,应选用的收集装置是 (填序号),该反应的化学方程式为 ,仪器①的下端必须伸入反应物液面以下形成“液封”,其原因是 。
(4)如图F所示装置可用来测量生成CO2的体积,其中在水面上放一层植物油的目的是 ;
(5)图G和图B都可用作实验室用锌粒和稀硫酸反应制取氢气的发生装置,G装置与B装置比较,G装置除了节约药品优点外,还有操作上的优点是 。
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氧气(化学式:NH3)。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。制取并收集NH3,应该从图中选择的发生装置是 (填序号),收集装置是 (填序号)。
参考答案:
【答案】(1)长颈漏斗 集气瓶 (2)A 2KMnO4![]() K2MnO4 + MnO2 + O2↑ 移离导管
K2MnO4 + MnO2 + O2↑ 移离导管
熄灭酒精灯 防止水倒流使试管炸裂 (3)C CaCO3+2HCl=CaCl2+CO2↑+H2O 防止二氧化碳从长颈漏斗处逸出(4) 防止二氧化碳溶于水(5)可以控制反应的开始和结束
(6)A E
【解析】
试题分析:(2)为固体需加热型 ;略 ;移离导管熄灭酒精灯以避免因温度降低压强减小使水倒流使试管炸裂;(3)为固液不需加热型;(4)二氧化碳易溶于水且又能与水反应都会消耗二氧化碳使测量结构减小;(5)控制活塞可以借助反应产生的气体来调节气压,能使液体进入和排出试管(即能使固液反应物接触和分离),就能控制反应的发生与停止;(6)为固体需加热型;氨气密度比空气小又易溶于水只能用向下排空气法。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各选项中物质的名称或俗名与括号内的化学式一致的是( )
A.高锰酸钾(KMnO4)
B.熟石灰(CaO)
C.硫酸铁(FeSO4)
D.烧碱(Na2CO3)
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法﹣﹣“联合制碱法”.“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O═NH4HCO3 该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图1:
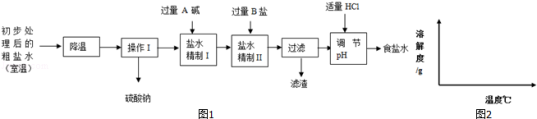
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图2)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .
其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
实验操作
实验现象
实验结论
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
温度
NH4Cl
NH4HCO3
NaHCO3
NaCl
30℃
41.1g
27.0g
11.1g
36.3g
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ -
科目: 来源: 题型:
查看答案和解析>>【题目】下列不属于氯化钠的用途的是( )
A.配制生理盐水注射液
B.腌制蔬菜
C.融化积雪
D.游泳池消毒
-
科目: 来源: 题型:
查看答案和解析>>【题目】 化学反应前后,下列诸项肯定没有变化的是: ①原子数目;②分子数目;③元素种类;④物质总质量;⑤物质种类;⑥原子种类
A.①②③④⑤⑥ B.①③④⑥ C.①④⑥ D.①③⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知氯化银(白色)、碳酸银(白色)、碳酸钙(白色)、氢氧化铜(蓝色)都难溶于水.下列溶液分别跟氯化铜溶液、稀盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.NaOH
B.H2SO4
C.AgNO3
D.Ca(OH)2
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列生活中常见的物质,其主要成分属于盐的是( )
A.活性炭(C)
B.水晶(SiO2)
C.草木灰(K2CO3)
D.食醋(CH3COOH)
相关试题

