【题目】某课外活动小组为测定铜锌合金粉末中铜的质量分数设计了下列实验:
①称取ag样品放入烧杯,滴入足量稀盐酸。②取一张质量为bg的滤纸,制作并安装好过滤器。③待①中反应充分后,过滤。④取沉淀连同滤纸放在干燥器中干燥后,称量,质量为cg。
回答下列问题:
(1)称量样品时,应把样品放在托盘天平的 盘里。
(2)如何判断①中反应已进行充分? 。
(3)过滤中发现滤液出现浑浊,应如何处理? 。
(4)整个实验过程中用到的玻璃仪器有烧杯、胶头滴管、 、玻璃棒、干燥器等。
(5)通过上述实验测得的铜的质量分数是 (用a、b、c表示)。
(6)老师指出,③、④之间缺少一个步骤,使得实验结果偏大。该步骤是 。
参考答案:
【答案】(1)左 (2)滴入盐酸时不再产生气体 (3)重新过滤 (4)漏斗
(5)![]() ×100%(6)洗涤沉淀
×100%(6)洗涤沉淀
【解析】
试题分析:(1)托盘天平的使用规则是左物右码,故样品应放在左盘;
(2)铜锌合金中的锌能与稀盐酸反应产生大量的气泡,当滴入盐酸时不再产生气泡时表示锌已经完全反应;
(3)过滤后滤液仍然浑浊,那么要重新过滤一次,若重新过滤后还是浑浊的,那么要检查原因;
(4)过滤时需要的一切有:铁架台、烧杯、漏斗、玻璃棒;
(5)锌与稀盐酸反应生成氯化锌和氢气,铜不与稀盐酸反应,故干燥后称量的质量是铜和滤纸的质量,故铜的质量=(c-b)g ,样品的质量为a g,故铜的质量分数为![]() ×100%;
×100%;
(6)由于铜片上可能会沾有氯化锌,故要把过滤后的铜进行洗涤,否则可能会导致实验结果偏大。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究燃烧的条件,小军查阅资料得知:白磷的着火点为40℃,红磷的着火点为240℃,五氧化二磷会刺激人的呼吸道。他设计了如图所示的实验装置。将分别盛有少量白磷和少量红磷的两支试管,放入到盛水的烧杯中,另将少量白磷直接投入到烧杯的水中。观察到的实验现象如下:
①试管中的白磷燃烧,产生大量的白烟;②试管中的红磷不燃烧;③烧杯中的白磷不燃烧。

(1)白磷燃烧的化学方程式为 。
(2)分析实验现象,得出结论。由现象①②得到的燃烧条件是 ,由现象①③得到的燃烧条件是 。
(3)请举一例说明燃烧必须有可燃物参加 。
(4)请你根据小军查阅的资料和实验现象,指出他设计的装置有何不足 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】能鉴别氢氧化钠溶液和氢氧化钙溶液的试剂是
A.酚酞试液 B.稀盐酸 C.碳酸钠溶液 D.硫酸铜溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类已能操纵原子制造分子,若用该方法制造葡糖糖(C6H12O6),不需要的原子是
A.氮原子 B.氧原子 C.氢原子 D.碳原子
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的俗名或主要成分与化学式不一致的是
A.烧碱:Na2CO3 B.天然气:CH4
C.生石灰:CaO D.干冰:CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是一门以实验为基础的科学。根据下图所示实验,回答以下问题。
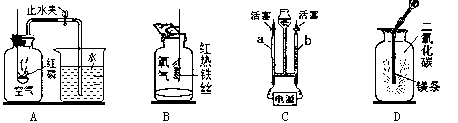
(1)A为测定空气中氧气含量的实验装置,有关反应的化学方程式为 ,通过该实验可得出氧气约占空气总体积的 的结论。
(2) 集气瓶B中的现象是铁丝在氧气中剧烈燃烧, ,放出大量的热,有黑色固体生成。该反应的化学方程式为 。
(3)1800年,英国化学家尼科尔森通过电解水得到了氢气和氧气。图C是水的电解装置,反应化学方程式为 ,实验证明了水是由 组成的化合物。
(4)用坩埚钳夹住已擦亮的镁条,放在酒精灯上点燃后,立即伸进盛有二氧化碳集气瓶中发现镁条剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体,该反应中生成白色固体是 ,本实验使你对燃烧条件产生的新认识是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学在能源利用、环境保护等方面起着重要的作用。下列有关做法错误的是( )
A.为治理雾霾,禁止使用化石燃料
B.变废为宝,将地沟油转发为航空燃油
C.城市道路使用太阳能景观灯,节能又环保
D.用二氧化碳和水等合成新型燃油,有利于减缓温室效应
相关试题

