【题目】初中化学学习中,我们初步认识了物质的微观结构。

(1)氯化钠、金刚石、干冰三种物质中,由离子构成的物质是_____。
(2) ![]() 为某粒子的结构示意图,相应元素在元素周期表中的信息如图, 该粒子在化学反应中容易________电子(填“得到”或“失去”)变为_____(微粒符号)。
为某粒子的结构示意图,相应元素在元素周期表中的信息如图, 该粒子在化学反应中容易________电子(填“得到”或“失去”)变为_____(微粒符号)。
(3)为减少污染、提高焦炭的利用率,可将焦炭在高温下转化为可燃性气体。此过程可认为是碳与水的反应,其微观示意图如下图所示:
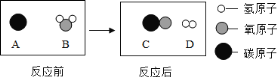
写出该反应的化学方程式_____,反应的基本类型是_____。
参考答案:
【答案】氯化钠失去Na+C+H2O![]() CO+H2置换反应
CO+H2置换反应
【解析】
(1)酸、碱、盐大都是由离子构成的,所以氯化钠是由离子构成的,金刚石是由原子构成的,干冰(二氧化碳)是由分子构成的。
(2)该粒子最外层只有1个电子,在化学反应中容易失去电子,失去一个电子带一个单位正电荷,成为Na+;
(3)A代表:C B代表:H2O C代表:CO D代表:H2 则化学方程式:
C+H2O![]() CO+H2 ,该反应属于置换反应。
CO+H2 ,该反应属于置换反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在利用红磷燃烧测定空气中氧气含量的实验中,用传感器记录集气瓶中压强、温度随时间变化的情况,如下图所示。其中a是打开止水夹的时刻。下列说法不正确的是
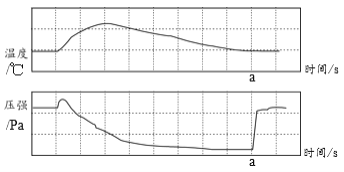
A. 反应开始时压强增大是因为温度升高
B. a点处的压强等于大气压
C. a点的温度已经接近室温
D. a点后气压增大是由于水倒吸入集气瓶
-
科目: 来源: 题型:
查看答案和解析>>【题目】某白色固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠中的一种或几种,为探究它们的成分,进行如下实验。

(1)白色沉淀A 是_____(选填“纯净物”或“混合物”)。
(2)操作 I 是_____(填分离方法)。
(3)通过以上实验可知,该白色固体甲中一定含有的物质是_____。
(4)写出生成无色气体D 的反应的化学方程式:_____。
(5)为进一步确认白色固体甲的组成,取少量无色溶液 B,加足量硝酸酸化,滴加_____溶液,若白色沉淀产生,说明白色固体甲还含有的物质是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验研究小组欲检验草酸晶体分解的产物并测定其纯度(杂质不发生反应)。
(查阅资料)
①草酸晶体(H2C2O42H2O)100℃开始失水,101.5℃熔化,189℃左右分解。
②无水硫酸铜遇水由白色变成蓝色。
③碱石灰既可吸收水也可以吸收 CO2
甲、乙两同学采用不同的方法检验草酸晶体分解的产物并测定其纯度:
(1)请完成猜想三
(猜想与假设)
猜想一:分解产物是 CO2、H2O 猜想二:分解产物是 CO、 H2O
猜想三:分解产物是_____。
(实验设计)
Ⅰ. 甲同学用下列实验仪器(图中某些加热装置已略去,实验所需药品不限)进行探究。
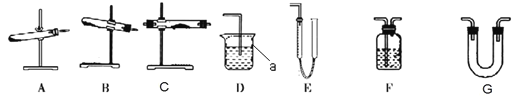
(2)仪器a 的名称是_____。
(3)用加热草酸晶体的方法获取气体,应该选择的气体发生装置是_____(填编号)。
(4)甲同学实验利用装置“G(碱石灰)—F—C(CuO 固体)—F”检验 CO,则 F 中盛装的试剂是_____,证明含有 CO 的现象是_____。
Ⅱ. 乙同学对装置进行了改进,设计的新装置如下图所示(所用容器为底部弯曲的试管)
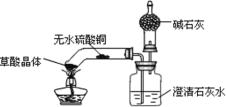
(实验过程)
乙同学加热试管后观察到无水硫酸铜由白色变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在干燥管的尖嘴处点燃,该气体能燃烧。通过进一步检验,确认燃烧的气体为 CO。
(实验结论)
(5)猜想_____是正确的,写出草酸晶体受热分解的化学方程式:_____。
(纯度计算)
乙同取样品a g,通过实验测得产生的CO 质量b g,则草酸纯度的表达式为_____。
(反思与评价)经过实验和讨论。请你对比两套装置,指出乙同学设计的装置优点是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是电解水实验的示意图,回答下列问题:
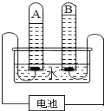
(1)写出该反应的化学方程式:_____。
(2)A 管接电池_____极(填“正”或“负”)。
(3)检验 B 试管中气体的操作方法和现象是_____。
(4)某学生观测记录了不同时间段A、B 试管内收集到的气体体积, 实验数据如下:
时间/分钟
1
2
3
4
5
6
7
8
9
10
A 试管气体体积(cm3)
6
12
20
29
39
49
55
65
75
85
B 试管气体体积(cm3)
2
4
7
11
16
21
26
31
36
41
仔细分析实验数据,1-4 min 内A、B 试管收集到的气体体积之比大于 2:1,可能的原因是____。
从第 8 分钟开始,每分钟内 A、B 试管收集的气体体积之比为 2:1,可能的原因是________。
(5)为进一步测定水中氢、氧元素质量比,某科技小组的同学设计了下列实验(装置如右图),通过称量反应前后装置 A、B 的质量,结果测得 m(H):m(O) >1:8,比理论值偏高,其原因可能是_____(填编号)。
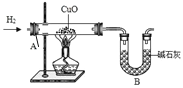
A.通入的氢气未经过净化干燥 B.装置 A 内管口有水凝结
C.氧化铜没有完全还原 D.装置B 同时吸收了空气中的水蒸气和CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学查阅资料得知:①Cu 与稀硫酸不反应,但 Cu 可与浓硫酸在加热的条件下反应,化学方程式为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2R。②有元素化合价升降的反应是氧化还原反应。下列说法不.正.确.的是( )
CuSO4+SO2↑+2R。②有元素化合价升降的反应是氧化还原反应。下列说法不.正.确.的是( )A. 该反应是氧化还原反应
B. R 为相对分子质量最小的氧化物
C. 硫酸铜是由铜离子和硫酸根离子构成的化合物
D. 反应中,SO2 和 R 的质量比是 32:9
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定质量的物质甲(相对分子质量是 90)在氧气中完全燃烧,消耗了 6.4 g 氧气,同时生成了 5.6 g CO、4.4 g CO2 和 5.4 g H2O,则下列对甲的说法中正确的是( )
A. 只含有碳、氢两种元素
B. 一定含有碳、氢元素、可能含有氧元素
C. 碳元素的质量分数为 40%
D. 若相同质量的甲在 8.6 g 氧气中完全燃烧,只生成二氧化碳和水
相关试题

