【题目】如图是 NH4Cl、NaCl和 NaHCO3三种物质的溶解度曲线。

(1)易溶物质是______________,可溶物质是_____________,
(2)30℃时,NaHCO3的溶解度是_________,该温度下,向100g水中加入40 gNaHCO3,所得溶液中溶质与溶液的质量比为__________
(3)下列说法正确的是_______________。
A.NH4Cl饱和溶液一定比不饱和溶液浓
B.饱和NaCl溶液析出晶体后,溶液中溶质的质量分数可能不变
C.30℃,分别将10 gNaCl和10gNH4Cl配制成饱和溶液,前者需要水的质量较多
D.40℃,分别将NaCl和NH4Cl的饱和溶液降温到20℃时,后者析出的晶体较多
参考答案:
【答案】 NaC1和NH4C1; NaHCO3 10g, 1:11 BC
【解析】(1)根据常温下溶解度大于10g的易溶物质,溶解度在1--10之间是可溶物质解答;(2)根据溶解度曲线分析解答;根据计算解答;(3)A、根据温度不确定分析解答;B、根据恒温蒸发溶剂解答;C、根据30℃时NaCl和NH4Cl的溶解度分析解答;D、根据溶液的质量分析解答。(1)在20℃时,氯化钠和氯化铵的溶解度大于10g,是易溶物质,碳酸氢钠的溶解度大于1小于10,是可溶物质;(2)由溶解度曲线可知,30℃时,NaHCO3的溶解度是10g,该温度下,向100g水中加入40gNaHCO3,只能溶解10gNaHCO3,故所得溶液中溶质与溶液的质量比为10g:(10g+100g)=1:11;(3)A、温度不确定,无法比较,错误;B、若采用恒温蒸发溶剂的方法,饱和NaCl溶液析出晶体后,溶液中溶质的质量分数不变,正确;C、30℃时NaCl的溶解度小于NH4Cl的溶解度,故将10gNaCl和10gNH4Cl配制成饱和溶液,前者需要水的质量较多,正确;D、溶液质量不确定,无法判断,错误。故选BC。
-
科目: 来源: 题型:
查看答案和解析>>【题目】创新发展材料技术可推动人类社会进步。
(1)碱式碳酸铝镁[AlaMgb(OH)c(CO3)·xH2O]既可以用作抗酸药,也常用于制作阻燃材料其化学式中的a、b、c、d需满足的代数关系式为_________________________________。
(2)城市建没需要大量的钢材、水泥、玻璃等建筑材料,水泥和玻璃属于_______________材料,钢筋混凝土属于_____________________材料。
(3)纳米TiO2是一种性能优良的光催化剂,可将其制成环保涂料涂覆于建筑物表面,利用光催化作用产生的活性氧(O3)和雨水使空气中的SO2转化为H2SO4,并吸附在催化剂表面,从而改善城市空气质量。写出上述过程中发生反应的化学方程式_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下面是几种实验室制取气体的发生装置与收集装置
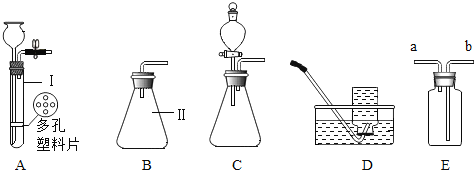
(1)写出仪器名称Ⅰ__________________,Ⅱ____________________。
(2)实验室制取氢气。若要较好地控制产生氢气的速度,应选用装置__________(填编号)
(3)D装置收集氢气,操作的正确顺序为____________(填编号)。
a.将导管伸入集气瓶口,气体进入瓶中 b.将装满水的集气瓶倒置在水槽中
c.当气体收集满时,用毛玻璃片上瓶口,将集气瓶移出水面放置
(4)若用E装置进行排空气法收集氢气,气体应从_______(填“a”或“b”)端进入
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与科学技术、生产生活及环境保护等密切相关。
(1)我省启动保卫碧水蓝天的“263“行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是__________;严格整治畜禽养殖场污染,主要是为减少_________和P等元素及化学需氧量对水体的污染。
(2)目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出脉素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________。
(3)三硅酸镁 Mg2Si3O8·nH2O具有治疗胃酸过多的作用,写出其与酸反应生成SiO2·H2O等物质的化学方程式_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在下图所示的物质转化关系中(反应物生成物均已给出),A为某种含硫矿物的主要成分且A中硫元素的质量分数为20%,反应①是工业上冶炼金属的一种方法。B、D、F、G是氧化物。C、E是单质,I的溶液呈蓝色。
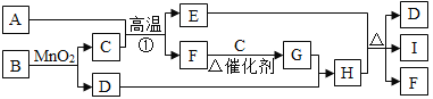
(1)A的化学式为_________________;
(2)G的化学式为_________________;
(3)E与H的浓溶液反应的化学方程式_____________________________________________;
(4)I的溶液与氢氧化钠溶液反应的化学方程式_______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如图1,几种物质的溶解度如图2:
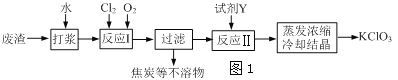
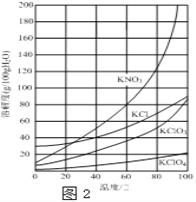
(1)反应Ⅰ生成Ca(ClO3)2和H2O,写出该反应的化学方程式:______________________________在通入Cl2和O2比例、废渣量控制一定的条件下,为使Cl2转化完全,可采取的合理措施是_______
A.缓慢通入Cl2、O2 B.搅拌浆料 C.控制合适的温度
(2)若过滤时滤液出现浑浊,其可能的原因是____________(填序号)
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
(3)所加试剂Y选用KCl而不用KNO3的原因是________________________________________;
(4)已知:4KClO3
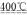 3KClO4+KCl ; 2KClO3
3KClO4+KCl ; 2KClO3  2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。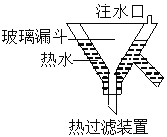
①由 KClO3制备高纯KClO4固体的实验方案:向坩埚中加入一定量的KClO3,控制温度为________℃,使KClO3充分分解,将所得固体溶于水加热至有大量固体析出,用热过滤装置,过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体。
②热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是________________________;
③用冰水洗涤滤渣的目的是_______________________________________________________;
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组同学去盐场观,带回了部分粗盐样品,并对其进行了如下探究:
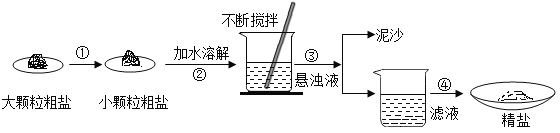
(1)操作①中必须用到的一种仪器名称是__________________;
(2)操作②中玻璃棒的作用为_______________________________;操作③的名称是__________;
(3)用提纯得到的“精盐”配制100g7.5%的氯化钠溶液经检测,溶质质量分数偏小,原因可能有_____________(填序号)
A.称量使用的砝码有缺损 B.精量时特盐与砝码放反了
C.量取水时仰视读数 D.装瓶时,有少量溶液酒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的一精盐”又作了如下处理:
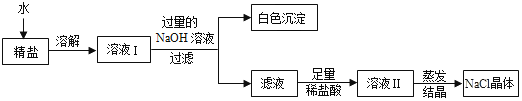
①生成白色沉淀的化学方程式________________________________________________;
②在得到的滤液中加入足量稀盐酸的目的是___________________________________________;
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将______________(填大于”、“小于”或“等于”)原精盐中NaCl的质量。
相关试题

