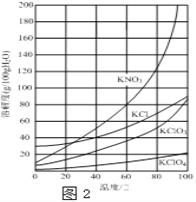
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如图1,几种物质的溶解度如图2:
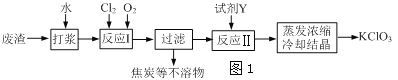
(1)反应Ⅰ生成Ca(ClO3)2和H2O,写出该反应的化学方程式:______________________________在通入Cl2和O2比例、废渣量控制一定的条件下,为使Cl2转化完全,可采取的合理措施是_______
A.缓慢通入Cl2、O2 B.搅拌浆料 C.控制合适的温度
(2)若过滤时滤液出现浑浊,其可能的原因是____________(填序号)
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
(3)所加试剂Y选用KCl而不用KNO3的原因是________________________________________;
(4)已知:4KClO3 ![]() 3KClO4+KCl ; 2KClO3
3KClO4+KCl ; 2KClO3 ![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
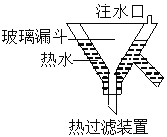
①由 KClO3制备高纯KClO4固体的实验方案:向坩埚中加入一定量的KClO3,控制温度为________℃,使KClO3充分分解,将所得固体溶于水加热至有大量固体析出,用热过滤装置,过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体。
②热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是________________________;
③用冰水洗涤滤渣的目的是_______________________________________________________;
参考答案:
【答案】 2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O ABC AB 防止产物中含有较多KNO3杂质 400 防止滤液冷却析出晶体堵塞漏斗 减少晶体损耗
【解析】(1)根据Ca(OH)2溶液与Cl2、O2在常温下反应生成Ca(ClO3)2和H2O解答;根据为使Cl2转化完全,可缓慢通入Cl2、O2或搅拌浆料或控制合适的温度解答;(2)根据过滤操作失误的原因是漏斗中液面高于滤纸边缘或滤纸已破损解答;(3)根据防止产物中含有较多KNO3杂质解答;(4)①根据题中信息解答;②根据防止滤液冷却析出晶体堵塞漏斗解答;③根据减少晶体损耗解答。(1)氢氧化钙溶液与氯气、氧气在常温下反应生成次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O;在通入Cl2和O2比例、废渣量控制一定的条件下,为使Cl2转化完全,可采取的合理措施是缓慢通入Cl2、O2或搅拌浆料或控制合适的温度,故选ABC;(2)若过滤时滤液出现浑浊,其可能的原因是漏斗中液面高于滤纸边缘或滤纸已破损,故选AB;(3)所加试剂Y选用KCl而不用KNO3的原因是防止产物中含有较多KNO3杂质;(4)①由题中信息可知,400℃时KClO3充分分解;②热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是防止滤液冷却析出晶体堵塞漏斗;③用冰水洗涤涤滤渣的目的是减少晶体损耗。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与科学技术、生产生活及环境保护等密切相关。
(1)我省启动保卫碧水蓝天的“263“行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是__________;严格整治畜禽养殖场污染,主要是为减少_________和P等元素及化学需氧量对水体的污染。
(2)目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出脉素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________。
(3)三硅酸镁 Mg2Si3O8·nH2O具有治疗胃酸过多的作用,写出其与酸反应生成SiO2·H2O等物质的化学方程式_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是 NH4Cl、NaCl和 NaHCO3三种物质的溶解度曲线。

(1)易溶物质是______________,可溶物质是_____________,
(2)30℃时,NaHCO3的溶解度是_________,该温度下,向100g水中加入40 gNaHCO3,所得溶液中溶质与溶液的质量比为__________
(3)下列说法正确的是_______________。
A.NH4Cl饱和溶液一定比不饱和溶液浓
B.饱和NaCl溶液析出晶体后,溶液中溶质的质量分数可能不变
C.30℃,分别将10 gNaCl和10gNH4Cl配制成饱和溶液,前者需要水的质量较多
D.40℃,分别将NaCl和NH4Cl的饱和溶液降温到20℃时,后者析出的晶体较多
-
科目: 来源: 题型:
查看答案和解析>>【题目】在下图所示的物质转化关系中(反应物生成物均已给出),A为某种含硫矿物的主要成分且A中硫元素的质量分数为20%,反应①是工业上冶炼金属的一种方法。B、D、F、G是氧化物。C、E是单质,I的溶液呈蓝色。
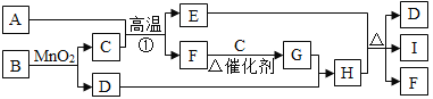
(1)A的化学式为_________________;
(2)G的化学式为_________________;
(3)E与H的浓溶液反应的化学方程式_____________________________________________;
(4)I的溶液与氢氧化钠溶液反应的化学方程式_______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组同学去盐场观,带回了部分粗盐样品,并对其进行了如下探究:
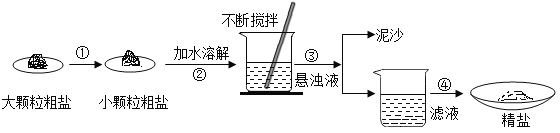
(1)操作①中必须用到的一种仪器名称是__________________;
(2)操作②中玻璃棒的作用为_______________________________;操作③的名称是__________;
(3)用提纯得到的“精盐”配制100g7.5%的氯化钠溶液经检测,溶质质量分数偏小,原因可能有_____________(填序号)
A.称量使用的砝码有缺损 B.精量时特盐与砝码放反了
C.量取水时仰视读数 D.装瓶时,有少量溶液酒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的一精盐”又作了如下处理:
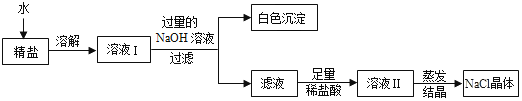
①生成白色沉淀的化学方程式________________________________________________;
②在得到的滤液中加入足量稀盐酸的目的是___________________________________________;
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将______________(填大于”、“小于”或“等于”)原精盐中NaCl的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳、硫的含量影响钢铁性能、某兴趣小组用如下流程对钢样进行探究。
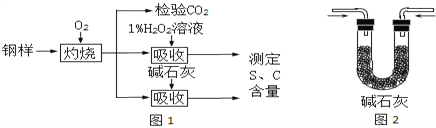
(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧生成两种氧化物,其中一种是固体,固体产物中Fe、O元素的质量比为21:8,则该固体产物的化学式为_________。灼烧的反应方程式为_________;
(2)钢样灼烧生成的气体是___________和___________,检验前者需要的试剂是_______________,检验后者需要的试剂是_____________________;
(3)取10.00g钢样在足量氧气中充分灼烧,将生成的气体用适量1%的H2O2溶液充分吸收,吸收液呈现酸性,用10g0.8%的NaOH溶液恰好将吸收液中和至中性;另取10.00钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如图2),碱石灰增重0.614g。
①用1%H2O2溶液吸收SO2,发生化合反应,化学方程式为_________________________________;
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体的溶解度曲线如下图所示,下列说法正确的是
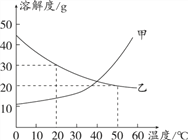
A. 20℃时,甲溶液中溶质质量一定小于乙溶液
B. 20℃时,可配制溶质质量分数为30%的乙溶液
C. 20℃时,100 g水中加入20 g甲得到不饱和溶液
D. 50℃时,甲的饱和溶液质量分数大于乙的饱和溶液质量分数
相关试题

