【题目】某研究小组对自动充气气球(示意图如下)进行下列探究。
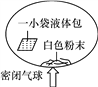
【查阅资料】该反应充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)为检验气体是二氧化碳,可选用________________(填试剂名称)。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,该溶液呈________性。
探究二:白色粉末成分的探究
【猜想与假设】甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
【设计并进行实验】
(1)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想____________(填“正确”或“不正确”)。
(2)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图),记录如下表:

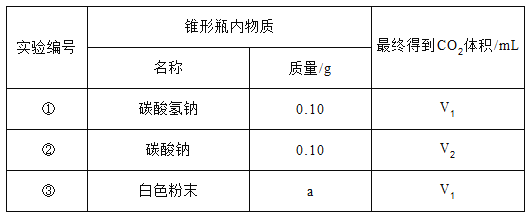
实验①的化学方程式为_________________________;表中a=_______;V1_____(填“>”“<”或“=”)V2。
【分析并得出结论】
如何从上表中获取证据并得出结论?__________________________________。
参考答案:
【答案】 澄清石灰水 酸 不正确 NaHCO3+HCl===NaCl+H2O+CO2↑ 0.10 > 根据表中CO2体积与锥形瓶内物质质量关系,实验③与实验①相同,可得出白色粉末的成分为碳酸氢钠(合理即可)
【解析】试题分析:(1)检验二氧化碳用澄清石灰水 (2)pH>7,溶液显碱性,pH =7,溶液显中性,pH<7,溶液显酸性,故当溶液的pH=3,该溶液呈酸性 (3)碳酸钙难溶解于水 (4)碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl==NaCl+H2O+CO2↑ 做对比实验时要控制变量,故a=0.10 设0.10g碳酸钠与盐酸反应生成二氧化碳的质量为x, 0.10g碳酸氢钠与盐酸反应生成二氧化碳的质量 为y Na2CO3+2HCl==2NaCl+CO2↑+H2O NaHCO3+HCl==NaCl+CO2↑+H2O
106 44 84 44
0.10g x 0.10g y
106 : 44= 0.10g : x 解得x=4.4g/106 84 :44= 0.10g :y 解得y=4.4g/84
故碳酸氢钠与盐酸反应生成的二氧化碳多,同温同压下,气体的质量越大,体积越大,
故V1>V2
(5)根据表中CO2体积与锥形瓶内物质质量关系,实验③与实验①相同,可得出白色粉末的成分为碳酸氢钠
-
科目: 来源: 题型:
查看答案和解析>>【题目】属于混合物的是
A.蒸馏水 B.氧气 C.石灰水 D.氯酸钾
-
科目: 来源: 题型:
查看答案和解析>>【题目】微观解释不正确的是
A.酒精挥发﹣﹣分子不断运动
B.二氧化碳气体制成干冰﹣﹣分子体积变小
C.18g水中大约有6.02×1023个水分子﹣﹣分子质量很小
D.50mL酒精和50mL水混合后总体积小于100mL﹣﹣分子间有间隔
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质的溶解度曲线如图所示,据图回答下列问题:
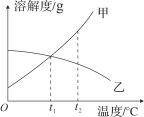
(1)乙物质的溶解度随温度的升高而 (填“增大”或“减小”)。
(2)欲将t1℃甲物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法: (任填一种)。
(3)若甲物质中混有少量乙物质,可用 的方法提纯甲。
(4)等质量甲、乙两种物质分别配成t2℃时的饱和溶液, 需要水的质量大小关系是甲 乙(填“>”、“=”或“<”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们在学习酸碱的化学性质时构建了如图所示的知识网络,A、B、C、D是不同类别的无机化合物,“—”表示物质在一定条件下可以发生化学反应。请回答下列问题:
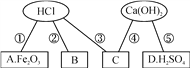
(1)反应①的化学方程式为_____________________,实验现象为______________________。
(2)写出图中一个中和反应的化学方程式:____________________________________。
(3)物质C应具备的条件是_________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了除去空气中的氧气而不增加其他气体的量,某同学采用燃烧法除去空气中的氧气,下列物质中最适宜选用的是…………………………………………………( )
A. 铁丝 B. 木炭 C. 蜡烛 D. 红磷
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是某胃药标签的部分内容。小明同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其他成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5克。称得反应后烧杯内物质的总质量为64.3克。请计算:

(1)反应完成后生成气体的质量为________。
(2)反应后烧杯中溶液的质量和胃药中NaHCO3的质量分数。
相关试题

