【题目】下图为某同学所做的实验及现象:

(1)实验一中发生两个反应,写出化学方程式____________、__________。
(2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。
【查阅资料】
① NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应;
② Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。
【实验验证】
① 将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有_________ 。
② 从实验二加热后的试管中分离出固体时,证明固体已洗涤干净的方法是____________。
③ 将②中所得固体溶于足量______________(选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
【结论】猜想②正确。
【拓展与思考】
若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式_________________ 。
参考答案:
【答案】 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 Cu(OH)2△CuO+H2O Cu(OH)2 最后一次洗涤液,滴加BaCl2溶液,没有沉淀产生,说明已洗涤干净 AB Cu4(OH)6SO4 + 2NaOH = 4 Cu(OH)2 ↓+ Na2SO4
【解析】(1).氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应方程式为: 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4,氢氧化铜在加热条件下分解生成氧化铜和水,反应方程式为: Cu(OH)2△CuO+H2O (2).氢氧化铜受热分解为黑色的氧化铜和水,Cu(OH)2分解温度为80℃,试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有Cu(OH)2; ②①过滤可以分离固体与液体,所以操作为过滤;固体已洗涤干净则表面不含硫酸钠溶液,可以取最后一次洗涤液,滴加BaCl2[或Ba(NO3)2、Ba(OH)2]溶液,无沉淀生成,则固体已洗净.③碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应;并且要验证有硫酸根离子,所以不能引入硫酸根离子,故用盐酸或稀硝酸都可以;(6). Cu4(OH)6SO4可以进一步与氢氧化钠反应生成氢氧化铜和硫酸钠,方程式为Cu4(OH)6SO4 + 2NaOH = 4 Cu(OH)2↓ + Na2SO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液)。主要生产流程如下:
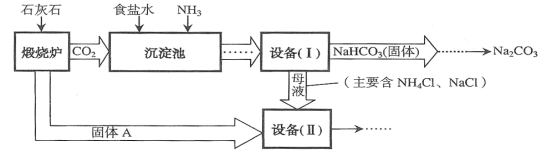
(已知2NH4Cl+Ca(OH)2==CaCl2+2NH3 ↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是 。
(2)若在实验室里分离“设备(I)”中的混合物,用到的操作的名称是 。
(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是 。该反应属于 反应(填写基本反应类型)。
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有 (填写化学式)。
(5)请写出一个该生产流程的优点: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】锌是人体必需的的微量元素,称“生命元素”。
【锌的广泛应用】
(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“_________ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指_____。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为___________________。
【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。

(1)粉碎的目的是___________________。
(2)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为___________(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和__________,
(3)物质X是__________,滤渣中含有的金属单质有__________,
(4)流程中获得七水硫酸锌前省略的操作是_______﹑冷却结晶﹑过滤、洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式__________。
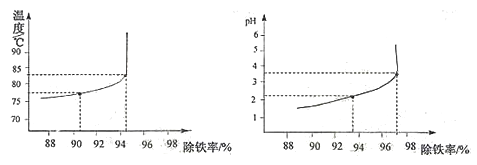
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在__________℃为宜,pH应控制在__________为宜。
【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验:
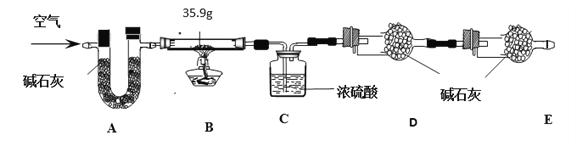
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3
 ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2 ZnO+H2O。
ZnO+H2O。现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(1)装置A的作用是_______________。
(2)若没有E装置,测得二氧化碳的质量____________(填“偏大”、“偏小”或“无影响”)。
(3)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =_____________ 。
【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高安炒粉营养美味,下列用到的食材中富含蛋白质的是( )
A. 米粉 B. 青菜 C. 瘦猪肉 D. 花生油
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定质量表面被氧化的镁条中,慢慢加入一定浓度的盐酸,反应中有关量的变化情况描述正确的是( )
A.
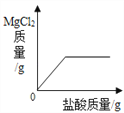 B.
B.  C.
C. 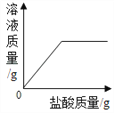 D.
D. 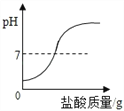
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列气体在食品包装中常用做防腐的是( )
A. 氮气 B. 氧气 C. 空气 D. 水蒸气
-
科目: 来源: 题型:
查看答案和解析>>【题目】预防甲状腺肿大(大脖子病)需适量补充的元素是( )
A. 氟 B. 铁 C. 碘 D. 硒
相关试题

