【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
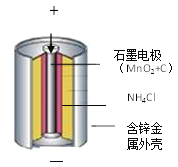
(知识储备)(1)锌锰电池的构造和组成(见图)。
(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图:

⑴流程图中试剂a的化学式是__________;得到的滤液1农业上可用作_____________。
(2)将滤渣B在空气中充分灼烧 可提纯制得的固体是___________,该方法提纯的原理是(用化学方程式回答)____________________________。
⑶将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、__________,可得到皓矾晶体(ZnSO4xH2O)。
II.皓矾晶体中结晶水含量的测定
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。
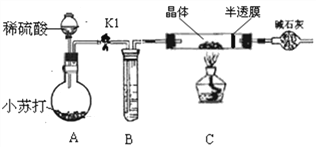
测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(ZnSO4xH2O == ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
⑷A中的化学方程式是_____________,B中的试剂可从下列物质中选取,你的选择是__________________。
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
⑸实验过程中若不通入CO2测得的结果将________(填“偏大”、 “偏小”或“无影响”)。
根据实验结果,计算皓矾晶体中结晶水的x值。计算过程:__________________
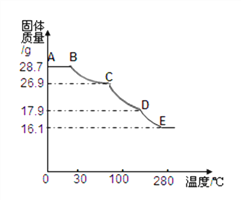
⑹将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如下图,写出D-E段发生反应的化学方程式________________
参考答案:
【答案】 H2O 氮肥 MnO2 C + O2 === CO2 冷却结晶 H2SO4 + 2NaHCO3 == Na2SO4 +2H2O + 2CO2 ↑ A 偏小 7 ZnSO4·H2O == ZnSO4 + H2O
【解析】本题以制备皓矾晶体、皓矾晶体中结晶水含量的测定为情境主要考查了物质的溶解,结晶,物质与氧气的反应,浓硫酸的性质,化学方程式的书写和化学计算,综合较强。
(1)固体混合物A中主要成分应NH4Cl、C、二氧化锰,其中氯化铵溶于水,碳和二氧化锰不溶,加水后氯化铵溶解其余的成分不溶,流程图中试剂a的化学式是水;得到的滤液1中含有NH4Cl,农业上可用作氮肥;
(2)滤渣中含有二氧化锰和碳,灼烧过程碳和空气中的氧气反应生成二氧化碳从而除去碳,化学方程式是:C + O2点燃CO2;
(3)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,硫酸锌的溶解度随温度的降低而减小。将滤液2蒸发浓缩、降温结晶,可得到皓矾晶体(ZnSO4xH2O);
(4)A中碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑;实验的目的是测定皓矾中结晶水的含量,不能使水蒸气随二氧化碳进入碱石灰中,所以B中的试剂具有吸水性,题中物质中只有浓硫酸具有吸水性,故选A;
(5)实验过程中若不通入CO2,则最后称量玻璃管中固体偏重,所得中结晶水的质量偏小,使测定的结果偏小;28.7g皓矾晶体中结晶水的质量为28.7g-16.1g=12.6g,ZnSO4质量为16.1g,则有161:18x=16.1g :12.6g,x=7;
⑹皓矾晶体加热会逐渐失去部分结晶水,D-E段产生的水的质量为17.9g-16.1g=1.8g。反应的化学方程式是ZnSO4H2O == ZnSO4 + H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】由于符合“低碳出行”的理念,“共享单车”颇受年轻人的喜爱。
(1)“低碳出行”主要减少的环境问题是_______________;
(2)下图所示自行车中的手套柄属于_________材料
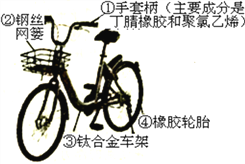
A.金属材料 B.合成材料 C.复合材料
(3)采用钛合金车架的“共享单车”质量轻便,承重强度高。钛原子的结构示意图为
 ,其中x=____;
,其中x=____;工业上冶炼钛的过程如下:
①2FeTiO3+6C+7Cl2
 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO ②在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为___________________,基本反应类型为___________反应。
(4)采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因_____________________;
(5)钢是铁合金的一种,工业上冶炼所需气体是____________(填化学式,下同),若发现车篓有锈斑,可用厨房中的__________来除。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室利用下图所示装置进行相关实验,请回答问题。
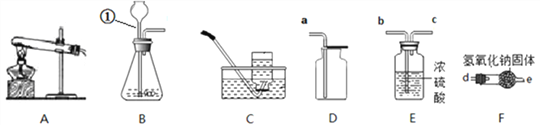
(1)图中标有①的仪器名称是_________。
(2)实验室利用氯酸钾和二氧化锰制氧气,反应的化学方程式为_____________________,应选择的发生装置是____________(填字母),选择C装置收集氧气,_____________________说明氧气已经收集满了。
(3)实验室制取二氧化碳的固体药品装在上述_________仪器中(填名称),化学方程式为__________________。若要得到干燥的二氧化碳,则发生装置产生的二氧化碳按气流方向连接顺序为(填导管接口字母):CO2
 ____
____ _____
_____  ____
____ (4)某学生想要通过碳酸氢铵分解产生的氨气来探究氨水具有碱性,而氨气不具有碱性。按下图所示进行实验:(滤纸条用石蕊试液浸泡并晾干) [资料]NH4HCO3
 NH3↑+H2O+CO2↑ 2NH3+H2SO4 ===(NH4)2 SO4
NH3↑+H2O+CO2↑ 2NH3+H2SO4 ===(NH4)2 SO4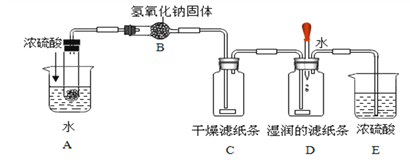
试分析:A装置中加入浓硫酸的作用是___________________________,B中氢氧化钠固体的作用是:Ⅰ.干燥气体;Ⅱ._____________(用化学方程式表示),该同学看到_______________现象,得出了正确的结论。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下:
已知:①反应Ⅰ的化学方程式:MnO2+SO2═MnSO4;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100℃时开始分解.
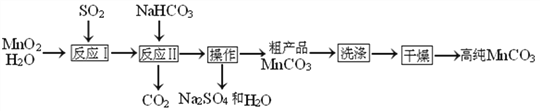
(1)MnCO3中Mn的化合价是________.
(2)流程中“操作”的名称为_____,所需要的主要玻璃仪器有_____(写一种即可).
(3)反应Ⅱ的化学方程式为________________.反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有_____________(填化学式).
(4)检验“洗涤a”已洗净的方法是______________________.
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述正确的是( )
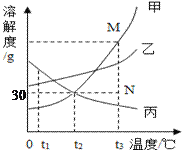
A. t2℃时,20g丙能溶解于50g水中形成70g溶液
B. 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法
C. t1℃时,等质量的甲、乙溶液中所含溶质的质量为乙>甲
D. t3℃时,将甲乙丙三种物质的饱和溶液降温到t2℃,所得溶液溶质质量分数的大小关系为乙>甲=丙
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像能正确反映其对应关系的是( )
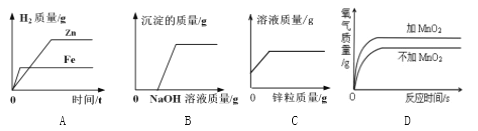
A. 向等质量的锌片、铁片分别加入足量的等质量分数的稀硫酸
B. 向CuSO4溶液中滴加NaOH溶液
C. 向一定量的稀硫酸中加入锌粒
D. 两份等体积的5%过氧化氢溶液,向其中一份加入少量二氧化锰
-
科目: 来源: 题型:
查看答案和解析>>【题目】铜屑表面呈绿色,欲利用其制取胆矾,某课外活动小组同学设计了如下制取流程。已知胆矾受热不稳定,易分解成硫酸铜和水。则有关该流程说法正确的是( )
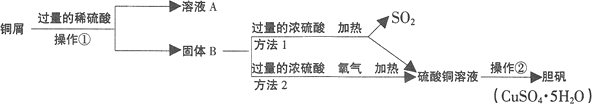
A. 操作①所用的玻璃仪器有烧杯、玻璃棒、漏斗
B. 铜屑表面呈绿色的物质俗称铜绿,化学式为Cu2(OH)2CO3
C. 由固体B制取硫酸铜溶液的过程中,方法1更符合绿色化学要求
D. 操作②的步骤为将硫酸铜溶液加热蒸干
相关试题

