【题目】将光亮镁条放入一定量的氯化铵溶液中,发现最终生成灰白色固体[Mgx(OH)yClz]外,还有气体生成。某同学对该现象作如下探究。
(一)生成气体可能是H2、HCl、NH3中的一种或几种。
(查阅资料)
①浓硫酸既可以吸收水,也可吸收氨气;
②常温下,氨气和氯化氢气体反应生成白色固体氯化铵(NH4Cl);
③2NH3+3CuO![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
④H2+CuO![]() Cu+H2O。
Cu+H2O。
(实验探究)收集气体,将气体通过如图装置(各步反应均完全);
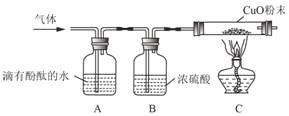
①A装置中出现红色,证明有_____;
②A、B实验装置_____(填“能”或“不能”)对调,理由是_____;
③C中玻璃管内观察到_____,证明有H2。
(反思与评价)他认为不需要单独检验HCl,就能证明HCl不存在,请你评价这种说法是否合理_________并说明理由___________。
(二)过滤、洗涤、一定温度下烘干得灰白色固体。
(查阅资料)灰白色固体Mgx(OH)yClz受热会分解,只生成MgO和HCl。
(实验探究)
取一定量灰白色固体样品,充分加热,得到4g白色固体和3.65g气体。
(结论)
①x:z=_____;
②若所得灰白色固体的相对分子质量为153,则所得灰白色固体的化学式是_____。
(反思与评价)有同学认为不需要任何数据,就可以求出x:z的值,请你说出理由_____。
参考答案:
【答案】氨气 不能 浓硫酸能够吸收氨气,无法检验氨气的存在 黑色粉末变成红色,玻璃管内壁出现水珠 合理 氯化氢和氨气不能共存 1∶1 Mg2(OH)2Cl2 由于Mgx(OH)yClz受热分解只生成MgO和HCl,根据化学式可知氢、氧原子个数比为1:1,则生成MgO和HCl的分子个数比为1:1,其中Mg、Cl原子个数比即x:z也为1:1
【解析】
(一)
[实验探究]
①氨气和水反应生成氨水,氨水显碱性能使酚酞试液变红色,氢气难溶于水,HCl溶于水得到的盐酸溶液不能使酚酞变色,所以装置A中出现红色,可以证明气体中有氨气,故填氨气(或NH3);
②浓硫酸既能吸收水又能够吸收氨气,如果A、B实验装置对调,浓硫酸吸收氨气后,再通过酚酞试液时,不能检验出是否含有氨气,故填不能;理由故填浓硫酸能够吸收氨气,无法检验氨气的存在;
③氢气和氧化铜在加热时反应生成铜和水,装置C的玻璃管内观察到黑色粉末变成红色,玻璃管内壁出现水珠,证明有H2,故填黑色粉末变成红色,玻璃管内壁出现水珠;
[反思与评价]
氯化氢和氨气在常温下能反应生成氯化铵固体,即二者不能同时共存,故填合理,理由是氯化氢和氨气不能共存;
(二)
[结论]
根据质量守恒定律和“得到4g白色固体和3.65g气体”可知灰白色固体样品质量为:4g+3.65g=7.65g,其中镁元素质量=4g×![]() =2.4g,氧元素质量=4g﹣2.4g=1.6g,氢元素质量=3.65g×
=2.4g,氧元素质量=4g﹣2.4g=1.6g,氢元素质量=3.65g×![]() =0.1g,氯元素质量=3.65g﹣0.1g=3.55g,根据题意得24x∶17y=2.4g∶(1.6g+0.1g), 解得x∶y=1∶1,故填1∶1;又知24x∶35.5z=2.4g∶3.55g,得出x∶z=1∶1,即x∶y∶z=1∶1∶1,设该灰白色固体的化学式为Mgn(OH)nCln,又知灰白色固体的相对分子质量为153,则24n+17n+35.5n=153,n=2,所以化学式为Mg2(OH)2Cl2,故填Mg2(OH)2Cl2;
=0.1g,氯元素质量=3.65g﹣0.1g=3.55g,根据题意得24x∶17y=2.4g∶(1.6g+0.1g), 解得x∶y=1∶1,故填1∶1;又知24x∶35.5z=2.4g∶3.55g,得出x∶z=1∶1,即x∶y∶z=1∶1∶1,设该灰白色固体的化学式为Mgn(OH)nCln,又知灰白色固体的相对分子质量为153,则24n+17n+35.5n=153,n=2,所以化学式为Mg2(OH)2Cl2,故填Mg2(OH)2Cl2;
[反思与评价]
由于Mgx(OH)yClz受热分解只生成MgO和HCl,根据化学式可知氢、氧原子个数比为1:1,则生成MgO和HCl的分子个数比为1:1,其中Mg、Cl原子个数比即x:z也为1:1,故填由于Mgx(OH)yClz受热分解只生成MgO和HCl,根据化学式可知氢、氧原子个数比为1:1,则生成MgO和HCl的分子个数比为1:1,其中Mg、Cl原子个数比即x:z也为1:1。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,回答有关问题:

(1)实验室常用锌粒和稀硫酸反应制取氢气,若要控制产生氢气的速率,应选择的发生装置是___(从A﹣F中选填字母),写出反应的化学方程式____;
(2)实验室现用G装置制取二氧化碳气体。
①检查装置的气密性:关闭活塞K,将干燥管放入带有水的烧杯中,若观察到____,则表明该装置的气密性良好。
②将装有石灰石的干燥管放入装有稀盐酸的烧杯内,同时打开活塞K,干燥管内发生反应的化学方程式为___,一段时间后,关闭导管上的活塞K,反应停止,其原理是___。该装置的优点是___。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水和溶液与人们的生活息息相关。
(1)KNO3和NaCl的溶解度曲线如图甲所示。20℃时取18gKNO3和18gNaCl分别放入两只烧杯中,各加入50mL水(水的密度近似看做1g/cm3),充分溶解,现象如图乙所示;升温到50℃时,现象如图丙所示。请回答下列问题:
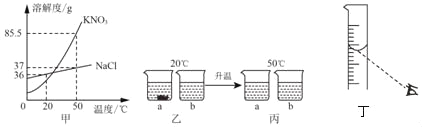
①乙图中,a烧杯溶液中溶质的质量分数____b烧杯溶液中溶质的质量分数(选填“>”、“<”或“=”)。
②要使丙图中的NaCl溶液恰好变成饱和溶液,需要加入____gNaCl固体。
③除去固体KNO3中混有的少量NaCl,实验步骤:先加水加热溶解,再____,然后过滤、洗涤、干燥。
④把溶质质量分数为6%的NaCl溶液稀释成50g质量分数为3%的NaCl溶液,需要水的体积是___mL.若采用图丁所示的操作来量取水的体积(其他操作均正确),则所得溶液的溶质质量分数____(选填“>”、“<”或“=”)3%。
(2)水是一种常用的溶剂,下列各组固体物质能用水鉴别的是____(填字母)。
A.碳酸钙和氯化钠 B.硝酸铵和氯化钠 C.氯化镁和氯化钠 D.氢氧化钠和氯化钠
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A~H是初中化学常见的物质,且分别由H、C、O、S、Fe、Cu、Ag中一种或几种元素组成。其中A、B、C、G为单质,B为紫红色固体,D、E、F为氧化物,D中两种元素质量之比为4:1,H的水溶液为蓝色。图中“﹣”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
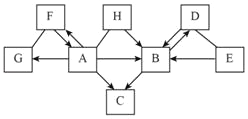
(1)写出化学式:G_____,H_____。
(2)写出D与E反应的化学方程式_____。
(3)写出B→C反应的化学方程式_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】燃料作为重要的能源,对于人类社会来说是非常重要的。
(1)家用燃料的发展历程如图所示,括号内的物质是该燃料的主要成分。
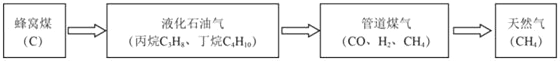
①下列说法不正确的是_____(填字母)
A.煤、石油、天然气都是化石燃料
B.液化石油气是石油化工的一种产品
C.可燃冰将成为未来新能源,其中主要含有丙烷水合物
D.等质量的甲烷和丙烷完全燃烧,生成的二氧化碳质量相等
②在相同的温度和压强下,相同体积的气体具有相同的分子数,反之亦然。在20℃101kPa下,1升一氧化碳和1升甲烷分别充分燃烧,消耗氧气的体积比为_____。
③使燃料充分燃烧通常考虑两点:一是燃烧时要有足够的空气;二是_____。
(2)乙醇(C2H5OH)是实验室常用的燃料。如果92g乙醇完全燃烧生成二氧化碳和水,至少需要氧气的质量是_____?(在答题纸上写出完整的根据化学方程式计算的过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入mgZn粉,充分反应后过滤,将滤渣洗涤、干燥后称量,得到的固体质量为mg。下列说法不正确的是( )已知:AgNO3+HCl═HNO3+AgCl↓
A. 滤渣中的物质至少有两种
B. 取滤渣滴加稀硫酸,一定有气泡产生
C. 取反应后的滤液观察,滤液一定呈浅绿色
D. 取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
-
科目: 来源: 题型:
查看答案和解析>>【题目】能源利用和环境保护是人类共同关注的问题。
2017年5月18日,我国宣告可燃冰试采成功,这在世界上也是首次。“可燃冰”是天然气和水在低温、高压条件下形成的冰状固体,遇火即可燃烧。可燃冰外观像冰,在地球上的储量大约是已探明其他化石然料总量的2倍;同等条件下,可燃冰燃烧产生的能量比传统的化石燃料要多岀数十倍,而且燃烧后不产生仼何的残渣和废气,是公认的地球上尚末开发的最大新型能源。
(1)化石燃料包括石油、_____和天然气;
(2)可燃冰作为新型能源,其充分燃烧的化学方程式为_____;可燃冰比传统化石燃料具有很多优势,主要是_____(填序号)。
A.储量丰富 B.燃烧值大 C.清洁、无污染 D.易于开采
(3)为防止天然气泄漏造成危险,家中报警器应安装在靠近气源的_____(填“上方”或“下方”);关闭天然气阀门熄灭火焰,其灭火原理是_____。
相关试题

