【题目】下图表示某些物质间转化关系。B、C、D、F、W均为氧化物,C和F组成相同,W和D组成也相同,W有消毒作用;X、Y、G均为单质,E是有机物(部分反应条件或某些反应产物未注明)。回答问题:

(1)化学式:A________、W________。
(2)区分C、F的一种试剂名称为:_______。
(3)物质B在反应③中的作用是_______
(4)反应②的化学方程式:_____________。
(5)工业上可用C和NH3合成尿素【CO(NH2)2】 ,反应中C和NH3的质量比为________。
参考答案:
【答案】 Cu2(OH) 2CO3 H2O2 澄清石灰水或Ca(OH)2溶液 加快反应的速度(催化作用或催化剂或催化) 2H2O![]() 2H2↑+O2↑ 22:17
2H2↑+O2↑ 22:17
【解析】本题为框图式推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其它结论。
根据题目给出的流程图和信息:W和D组成相同,W有消毒作用,W是过氧化氢,D是水; B、C、D均为氧化物,碱式碳酸铜在加热的条件下生成氧化铜和二氧化碳和水,因此A可能是碱式碳酸铜,则B是氧化铜,C是二氧化碳;水和二氧化碳反应生成X和E,X为单质,E是有机物,则X可能氧气,E为葡萄糖;氧化铜和酸溶液能形成蓝色溶液,蓝色溶液和铁反应生成G,G为单质,则G是铜;水通电生成Y,Y为单质,则Y为氢气或氧气;C和F组成相同,C是二氧化碳,则F是一氧化碳,一氧化碳具有还原性能生成铜;水和CH4在催化剂的作用下生成一氧化碳和Y,Y为单质,根据质量守恒定律,则Y为氢气;氧化铜(B)与过氧化氢混合后有氧化铜(B),水(D)和X,X为单质,则X为氧气,氧化铜在反应中用作催化剂。代入框图,假设成立。因此:
(1)化学式:A是碱式碳酸铜,化学式是Cu2(OH) 2CO3,W是过氧化氢,化学式是H2O2;
(2) C、F分别是CO、CO2,CO2能使澄清石灰水变浑浊,CO不能使澄清石灰水变浑浊。区分CO、CO2的试剂可以是澄清石灰水或Ca(OH)2溶液;
(3)氧化铜在反应③中的作用是加快反应的速度(催化作用或催化剂或催化);
(4)反应②是水通电分解生成氢气和氧气,化学方程式是2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(5) 工业上可用CO2和NH3合成尿素[CO(NH2)2]和水,二氧化碳和氨气反应的方程式为:CO2+2NH3 ![]() CO(NH2)2+H2O,反应中二氧化碳和NH3的质量比为44:(2×17)=22:17。
CO(NH2)2+H2O,反应中二氧化碳和NH3的质量比为44:(2×17)=22:17。
-
科目: 来源: 题型:
查看答案和解析>>【题目】随州市某初中学校九年级化学兴趣小组学完“盐的性质”后进行下图两个实验。
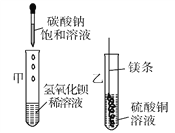
(1)甲实验中反应的化学方程式为__________________。
(2)乙实验观察到的现象是________________________。
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(作出猜想)白色沉淀为:Ⅰ._____________;
Ⅱ.Mg(OH)2和BaSO4;Ⅲ. Mg(OH)2和MgCO3。
(实验方案)请你设计一种实验方案证明猜想Ⅲ成立。
实验操作
实验现象与结论
_________________
_____________________,猜想Ⅲ成立。有关化学反应方程式为:(写一个即可)________________。
(拓展与思考)如果猜想Ⅱ成立,产生此结果的原因是做甲实验时__________________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下图回答问题:

(1)仪器名称:①________,②______。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置______(选填序号)和D组合,反应的化学方程式为________,二氧化锰的作用是_______。
(3)实验室可用装置B或C制H2,C装置相对于B的优点有__________。用E装置收集H2,气体应从________(选填“a”或“b”)端通入。
(4)有同学将实验室制得的CO2通入澄清石灰水,石灰水未变浑浊,于是作如右图探究:
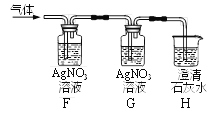
①实验室制CO2反应的化学方程式_________。
②装置F、H中溶液变浑浊,G中溶液不变浑浊,则原石灰水未变浑浊的原因是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、FeCl3、NaCl和Ba(NO3)2中的一种或几种,为确定其组成,现做如下实验:取少量固体加足量的水溶解,过滤得沉淀Ⅰ和无色溶液Ⅰ,后续实验及现象如下图:
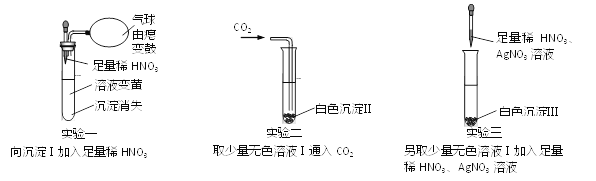
试回答:
(1)沉淀I中成分有_____________(有2种)。
(2)白色沉淀II是______,生成白色沉淀II总反应的化学方程式_________。
(3)通过上述实验,固体粉末中不能确认的物质是NaCl和_______,其中不能确认NaCl的原因是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小辉在课外研究性学习活动课上用如图所示的装置做实验,瓶内放了足量的硫酸,可充气的气球放有一定量的 铁粉,将它紧紧套在瓶口上,放在托盘天平上称量,质量为M1,然后将气球内的铁粉全部倒入瓶内,立即产生氢气, 气球逐渐胀大,充分反应后最终再次称量,质量为 M2,结果 M1>M2,试分析:
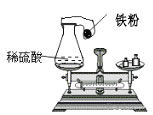
(1)此反应是否符合质量守恒定律?________(填“符合”或“不符合”)
(2)天平显示 M1>M2 的原因是(装置不漏气)_________ 。
(3)小辉为了测定所用稀硫酸的溶质质量分数,又用150克稀硫酸分三次和一定质量的铁粉进行实验,所得实验数据如下:
物质质量
第一次
第二次
第三次
加入稀硫酸质量(克)
50
50
50
剩余固体质量(克)
11.4
5.8
0.2
通过以上表格分析,小辉所用铁粉的质量是____克;完全反应后所得溶液的溶质质量分数为_____(只需写出计算表达式)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过分析下列实验或现象,可以得出相应的结论,其中不合理的是( )
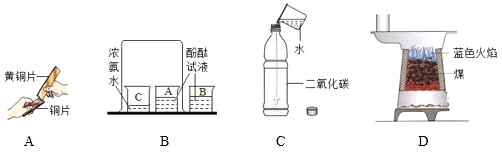
A. 实验中黄铜片能在铜片上刻画出痕迹,说明黄铜的硬度比铜片大
B. 实验既可以说明分子在不停地运动着,又可以说明氨水显碱性
C. 实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性
D. 图中煤炉里煤炭上方燃烧产生的蓝色火焰说明一氧化碳具有可燃性
-
科目: 来源: 题型:
查看答案和解析>>【题目】材料是人类赖以生存和发展的重要物质,铜是目前使用最广泛的金属之一。
(一)铜材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是________。
(2)纯铜又称紫铜,常见铜合金有黄铜、青铜等种类。家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹。
① 以上叙述中不涉及到的材料是_______(选填序号)。
A.金属材料 B.无机非金属材料 C.有机合成材料
② 我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_______。
③ 鉴别黄铜和黄金,以下方法不可行的是______(选填序号)。
A.观察颜色 B.加稀盐酸 C.在空气中灼烧
(二)铜及其化合物的实验
I.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法。
(1)方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色。
①反应中溶液的PH逐渐_________(填“增大”或“减小”)。
②该反应的化学方程式_________。
(2)方案2:将铜片加入浓硫酸中,加热,产生刺激性气味,溶液逐渐变成蓝色。将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是________。
(3)从环保角度进行比较,你认为方案_______(填“1”或“2”)更合理。
Ⅱ.在一定量硫酸铜溶液中加入碳酸钠溶液,过滤、洗涤、低温干燥得到碱式碳酸铜固体,其组成为:xCuCO3·yCu(OH)2·zH2O。能证明固体已洗净的方法为__________。
(三)碱式碳酸铜的热分解实验
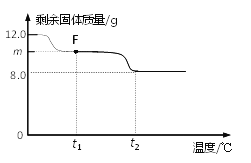
兴趣小组称取此固体12.0g,在科研人员的指导下用下图装置进行热分解实验。

【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物。该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近。
(1)装置A的作用是___________。
(2)加热前后及过程中均通入空气,加热后通空气的目的是________。
(3)控制温度在不同的范围对B中样品加热。测得装置C、D的质量在实验前后的变化情况如下表所示,测得B中剩余固体质量随温度的变化如下图所示。
装置
实验前/g
实验后/g
C
198.0
199.8
D
221.0
223.2
①图中F点对应的m=__________。
② 根据提供的数据, xCuCO3·yCu(OH)2·zH2O中x ﹕y ﹕z = _________。
③ 若缺少装置E,测得的________(选填“x”、“y”、“z”)的值会偏大。
相关试题

