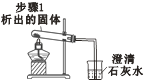
【题目】学习了《海水“制碱”》一课后,同学们模拟“侯氏制碱法”进行实验.
(查阅资料)氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
(模拟实验)验证侯氏制碱法能获得纯碱
步骤 | 实验装置 | 实验操作及现象 | 解释与结论 |
(1) |
| 先从a管通入____(填 “CO2”或“NH3”),一段时间后,再从b管通入___(填“CO2”或“NH3”),溶液中有固体析出 | 蘸有稀硫酸的棉花可吸收过量的氨气,以免挥发到空气中。 |
(2) |
| 充分加热,观察到的现象是:试管口有水珠,烧杯中的导管口有气泡冒出,____。 | 步骤1析出的固体是碳酸氢钠 |
(3) |
| 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |
步骤1发生反应的化学方程式为 ______________。
(实验反思)(1)同学们认为步骤3的实验还不足以得出“步骤2加热后得到的固体是纯碱”的结论,经过讨论,大家一致认为需要补充的实验是____________。
(2)也有同学认为制得的纯碱中可能含有氯化钠杂质, 于是又设计了以下实验并得出结论:
实验操作 | 实验现象 | 实验结论 |
_________ | ____________ | 制得的纯碱中含有氯化钠 |
参考答案:
【答案】 NH3 CO2 澄清石灰水变浑浊 NaCl + H2O + NH3 + CO2 = NaHCO3 + NH4Cl 先加入过量氯化钙,观察是否浑浊,取澄清溶液,再滴加盐酸观察是否有气泡。 取纯碱样品于试管中加水溶解,加入过量稀硝酸,后滴几滴硝酸银溶液 先有气泡产生,后产生白色沉淀。
【解析】【模拟实验】(1)氨气极易溶于水,所以a试管应该添加氨气,b试管添加二氧化碳,反之二氧化碳无法充分溶解和反应。
(2)因为碳酸氢钠受热分解生成二氧化碳气体,所以根据结论反推,可以得到二氧化碳使石灰水变浑浊的现象
故可以猜测反应产物为碳酸氢钠,根据元素守恒可得另一物质可能为氯化铵
【实验反思】(1)因为固体还有可能是碳酸氢钠和碳酸钠的混合物。故需要检测其中时候还有碳酸氢钠。所以先加入过量氯化钙,观察是否浑浊,取澄清溶液,再滴加盐酸观察是否有气泡。
(2)要检验氯离子需要用硝酸酸化的硝酸银,硝酸是去除碳酸根的影响,银离子检验氯离子。故现象是先由硝酸和碳酸钠产生气体,然后氯离子和银离子产生沉淀
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们用碳酸钠溶液和浓盐酸来研究简易灭火器的反应原理时,对废液的成分进行了探究.
(推理假设)上述两种物质反应的化学方程式为 ______________________ .由此推测出反应后废液中的溶质一定有_______,可能有碳酸钠或盐酸.
(实验探究)
(一)确定废液中是否含有盐酸
(1)选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的 ______ 溶液.
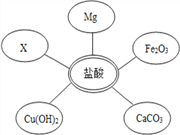
(2)实验验证:某同学甲向废液中加入少量的镁粉,观察到 __________ ,确定废液中一定没有盐酸.
(二)确定废液中是否含有碳酸钠
某同学选用 ______ 测出废液的pH=10,由此确定废液中_______________。
(三)处理废液,回收利用
欲从废液中得到纯净的NaCl,设计了如下实验方案,请完成方案评价.
方案
加入试剂
分离方法
方案评价
一
适量的Ca(NO3)2溶液
过滤、蒸发结晶
______ (选填“可行”或“不可行”,下同)
二
适量的稀盐酸
蒸发结晶
______
-
科目: 来源: 题型:
查看答案和解析>>【题目】炒菜时加入料酒和食醋,炒出的菜别具香味,其原因之一是料酒中的乙醇与食醋中的乙酸反应生成乙酸乙酯(C4H8O2),试计算:
(1)乙酸乙酯的相对分子质量为______。
(2)乙酸乙酯中氢元素与氧元素的质量比为________
(3)17.6g乙酸乙酯中所含氧元素的质量为______g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图示与对应的叙述相符的是
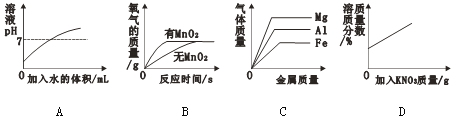
A. 表示向稀盐酸中不断加水
B. 表示探究过氧化氢制氧气的反应中二氧化锰的作用
C. 向等体积、等浓度稀盐酸中加入金属
D. 20℃时,向一定量的接近饱和的硝酸钾溶液中加入硝酸钾固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
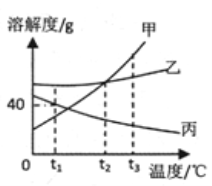
(1)t1 ℃时,将25 g丙加入到50 g水中充分溶解后所得溶液的质量为_______ g。
(2)t2 ℃ 时,甲的溶解度_______(填“>”、“<”或“=”)乙的溶解度。
(3)甲中含有少量的乙,欲提纯甲应采用的方法是________。
(4)将100 g 10%的甲溶液稀释到4%需加入______g 水。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)电解水实验中,正极产生的气体是__________(填化学式),正极与负极产生气体的体积比约为_________。
(2)如下图是将树木纤维素转变为超级储能装置反应的微观示意图。请回答下列问题:

①反应前后,原子的_________、数目和质量都不变;
②该反应的化学方程式为_______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的常见装置。
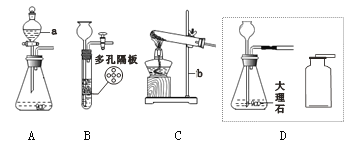
(1)写出所指仪器名称:a_________________,b_________________;
(2)实验室制取CO2的化学方程式是_________,发生装置选用B比选用A的突出优点是________。用装置D制取并收集CO2,请在虚框内补全导管_________。
(3)实验室用氯化铵(固体)和熟石灰(固体)混合加热制氨气,发生装置为________(填编号),发生反应的化学方程式为________________。
相关试题