【题目】食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和 。
②在蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。

①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是 (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有 (用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。已知:20 ℃时氯化钠的溶解度为36g。
参考答案:
【答案】(1)①漏斗 ②蒸发皿中出现较多固体时
(2)①BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl ②Na2CO3、NaCl 、NaOH
(3)加入22.4kg氯化钠固体
【解析】试题分析:(1)①操作Ⅰ是过滤,所用的玻璃仪器有:烧杯、玻璃棒和漏斗
②在蒸发过程中,待蒸发皿中出现较多固体时时,停止加热,利用余热将滤液蒸干
(2)①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是除去过量的氯化钡溶液,化学方程式为:BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl
②因为加入NaOH是除去杂质MgCl2,方程式为:MgCl2+2NaOH==Mg(OH)2↓+2NaCl,加入BaCl2是除去杂质Na2SO4,方程式为:Na2SO4+BaCl2==BaSO4↓+2NaCl,加入Na2CO3是除去杂质CaCl2外,还除去过量的氯化钡溶液,方程式为:CaCl2+Na2CO3==CaCO3↓+2NaCl,BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl ,故通过操作Ⅲ所得滤液中的溶质有Na2CO3、NaCl 、NaOH
(3)溶质质量分数为10%的氯化钠不饱和溶液100 kg,溶质氯化钠质量为10kg,溶剂为90kg,故设需加入氯化钠的质量为x,列式为:(10kg+x):90kg=36g:100g,x=22.4kg,故可采用的最简便方法是加入22.4kg氯化钠固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】请按要求完成下列金属性质的实验:
研究一:金属与酸反应过程中的能量变化.
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应_____(填“吸热”或“放热”),反应的化学方程式为______________.
(2)实验测得反应中产生的气体的速率(v)与时间(t)的关系如图,请根据t1﹣t2时间段反应速率变化,说明化学反应速率受___________________等因素影响.

研究二:金属与盐溶液反应过程中的相关变化.
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为_____________.
(2)在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,下图描述相关变化曲线,一定不正确的是____________.

-
科目: 来源: 题型:
查看答案和解析>>【题目】归纳是学习的重要方法,小芳在复习盐酸的性质时,归纳出盐酸的五条化学性质(如图1所示,连线表示相互反应);小明为表示反应实质绘制图2、图3.请根据下列图示和要求回答问题:

(1)图1中为了验证性质①,小红将紫色石蕊溶液滴加到盐酸溶液中,溶液变 色;图1中A所表示的物质类别是 .
(2)图2描述了氢氧化钠溶液与盐酸反应的微观实质,图2中A、B、C处应填入的化学式或离子符号依次为 .
(3)图3是镁和盐酸反应过程的微观示意图,从微观角度看,该反应有效相互作用的微粒是 (写微粒符号,下同),产生的新微粒是 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学与生活密切相关,在厨房里蕴藏着许多化学知识.
(1)下列食物中,能提供大量维生素的是__(填字母序号);

(2)厨房中的下列物品中,所使用的主要材料属于天然纤维的是__(填字母序号);

(3)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_______的功能;
(4)厨房中能用来除去水壶中水垢的物质是______(填“食醋”或“食盐水”).
(5)防止厨房菜刀生锈,可采用的防锈措施有:___________(写出一种即可).
(6)小明家厨房用的是天然气作为燃料,天然气在空气中完全燃烧的化学方程式为_______________________________________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年4月10日“国际环保环卫展”在北京举行,下列做法不符合环保主题的是
A. 垃圾焚烧 B. 随手关灯 C. 以步代车 D. 废铁回收
-
科目: 来源: 题型:
查看答案和解析>>【题目】在水、铁粉和氦气三种物质中,由原子直接构成的物质是(填化学式) 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组以“稀硫酸与氢氧化钠溶液能否发生反应”为课题进行了科学探究。如图1所示,小组同学向烧杯中的氢氧化钠溶液加入稀硫酸,一会儿会发现忘记了滴加指示剂,因此,他们停止滴加稀硫酸,并对烧杯内稀硫酸与氢氧化钠溶液是否发生了反应进行探究。
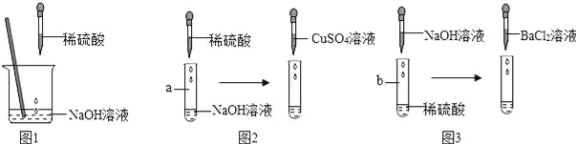
(1)小组同学设计了以下实验方案:
实验步骤
实验现象
实验结论
在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH
pH 7
(填“>”、“=”或“<”)稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了
(2)写出该反应的化学方程式: 。
(3)同学们经过讨论一致认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲、乙两组继续试验:
甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应。
【实验操作及现象】如图2,向a试管中滴加足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现蓝色沉淀。
【实验结论】通过以上实验操作及现象,你认为用CuSO4溶液 (填“可以”或“不可以”)证明稀硫酸与氢氧化钠溶液能发生反应。
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应。
【实验操作及现象】如图3,向b试管中滴加足量NaOH溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀。
【实验结论】通过以上实验操作及现象,你认为用BaCl2溶液 (填“可以”或“不可以”)证明稀硫酸与氢氧化钠溶液能发生反应,理由是 。
相关试题

