【题目】下列说法中正确的是( )
A. 某物质的饱和溶液转变为不饱和溶液后,溶液中溶质质量分数一定减小
B. 将6g碳放在盛有12g氧气的密闭容器中燃烧,两者充分反应后,密闭容器中的物质是混合物
C. 某碳酸钙和氧化钙的混合物含钙50%,取此混合物80g,加入足量稀盐酸充分反应后可得氯化钙的质量为111g
D. 恰好中和一定质量的稀硫酸,需用掉100g质量分数为5%的氢氧化钠溶液,若改用100g溶质质量分数为5%的氢氧化钾溶液,则反应后溶液的pH>7
参考答案:
【答案】BC
【解析】A、根据不饱和溶液和饱和溶液的转化方法可以知道,通过改变温度方法可以将饱和溶液转变为不饱和溶液,根据溶质的质量分数的计算公式可以知道此时溶液中溶质的质量分数不变,故错误;B、根据化学方程式 2C+O2点燃 2CO;C+O2点燃 CO2可知,当 m(C):m(O2)=24:32=3:4时,二者恰好完全反应生成CO;当 m(C):m(O2)=12:32=3:8时,二者恰好完全反应生成CO2,由题给条件 m(C):m(O2)=6:12=1:2;介于3:8-3:4之间,说明生成物中既有CO也有CO2,即密闭容器中的物质是混合物,故正确;C、80g碳酸钙和氧化钙的混合物中含钙元素的质量为80g×50%=40g,
设溶质CaCl2的质量为x,
Ca~CaCl2
40 111
40g x
![]()
x=111g,故正确;D、设需要中和等质量的硫酸需要氢氧化钾的质量为y,由化学方程式2KOH+H2SO4=K2SO4+2H2O、2NaOH+H2SO4=Na2SO4+2H2O可知:
2NaOH~H2SO4~2KOH
80 112
100g×5% y
![]()
y=7g>100g×5%,所以氢氧化钾的量不足,反应后硫酸有剩余,溶液显酸性,pH<7,故错误。故选BC。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室开放日,化学小组的同学来到实验室,对酸的性质很感兴趣,向老师提出研究硝酸的性质,老师高兴答应并带领同学们进行了硝酸性质的实验探究。
(1)(实验设计)
①将石蕊试液滴入稀硝酸中,预计石蕊试液由紫色变________色。
②将Zn片投入稀硝酸中,预计将产生氢气。
(2)(实验验证)
同学们按上述设计做了实验,却发现石蕊变色后一会儿即褪去,Zn片投入稀HNO3后,溶液中冒出气泡,产生无色气体A,在试管口气体A变成红棕色有刺激性气味的气体B。
(提出问题)
①石蕊试液变色后为何会褪色?
②上述产生的无色气体是什么?硝酸具有哪些特性?
(查阅资料)
看到如此异常的现象,在老师的指导下,同学们上网查到了下列资料:
①硝酸可与Zn、Cu等多种金属反应生成相应的硝酸盐,但不生成H2。
②含氮元素的某些气态物质的物理性质:
NH3
N2
NO
NO2
颜色
无色
无色
无色
红棕色
溶解性
极易溶于水
不溶于水
不溶于水
可溶于水或硝酸
(猜想与分析)
小明同学认为石蕊变色后又褪色的原因是由于试管不干净,含有其他杂质造成的,要证明小明的观点,应进行的操作是________。
(3)大家一致认同了红棕色气体B是NO2 , 但对于无色气体A及变化的原因有不同的看法:
①小丽同学认为A是NH3 , 但遭到了大家的一致反对,原是________。
②小强同学认为A是N2 , 也遭到大家的一致反对,原因是________。
③经讨论,最终大家获得了A是NO,NO在试管口遇氧气生成NO2的共识。
(4)(实验探究)
小红同学对硝酸与Cu反应很感兴趣,便取了一小块Cu片投入稀HNO3中,发现Cu片溶解,也出现了上述Zn与稀HNO3反应的类似现象,确认生成了NO,并在老师的帮助下,测出恰好反应的Cu和HNO3的化学计算量数之比为3:8,由此获得了Cu与稀HNO3的反应化学方程式________。
(5)(交流与反思)
①根据探究结果,请你解释稀HCl跟Cu不反应而稀HNO3却能跟Cu反应的原因________。
②实验室制取氢气________(填“能”“不能”)用稀硝酸。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年5月18日,中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变。可燃冰是在高压低温环境条件下,水分子笼中装有甲烷分子而成的“冰块”,可直接点燃。己知某种可燃冰的化学式为:CH4·8H2O。请回答:
(1)这种可燃冰中含有______种元素:原子个数比:C:H:O=________;
(2)这种可燃冰中甲烷的质量分数为________%;936g(约1升)该可燃冰常温下可释放出____升甲烷(常温下甲烷密度为0.72g/L)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定某稀硫酸的溶质的质量分数,小兰同学设计了如下实验方案.

第②步实验中生成沉淀的质量与加入NaOH溶液的质量关系如图.
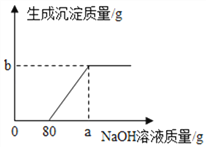
(1)分析第②步实验:与先加入的80g NaOH溶液反应的物质是_____(填化学式),继续加入NaOH溶液后产生的沉淀是_____(填名称)
(2)计算稀硫酸的溶质的质量分数______________(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】建立宏观、微观和符号之间的相互联系是化学学科的特点。构成物质的粒子之间的关系如图所示。
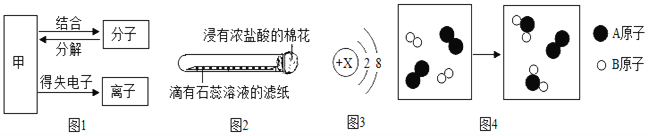
(1)图1中甲表示的是_____;
(2)氧气、汞和硫酸铜三种物质中,由离子构成的是_____ (写化学式);
(3)如图2所示,将滴有石蕊溶液的滤纸放入试管中,试管口放置一没有浓盐酸的棉花,可观察到的现象是滤纸从右到左变_____色;
(4)图3为某粒子的结构示意图,当X=_____时,该粒子是原子;
(5)图4为某化学反应的微观示意图,该化学变化中发生根本改变的粒子是_____(填“原子”或“分子”),变化过程中同种原子的个数_____(填“有”或“没有”)改变;参加反应的A2与B2两种物质的分子个数比为_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是人类宝贵的自然资源,与人类的生产、生活密切相关。
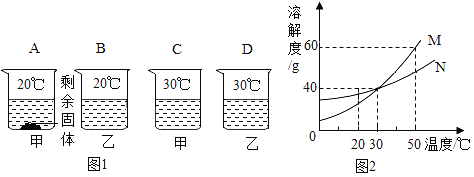
(1)生活中常用_____的方法将硬水进行软化。
(2)如图为甲、乙两种物质的溶解情况及溶解度曲线。
①将等质量的甲、乙固体分别加入到盛有100g水的A、B、C、D烧杯中,充分搅拌后,其现象如图1所示,图2中表示甲物质的溶解度曲线的为_____ (填“M”或“N”); 四个烧杯中的溶液一定是不饱和溶液的是_____(填字母编号);C和D烧杯中两溶液中溶质质量分数_____ (填“相等”或“不相等”);
②在30℃时,乙物质的溶解度为_____g;此温度下,将100g乙物质的饱和溶液,恒温蒸发10g水后,可析出乙物质的质量为_____g;
(3)在50℃时,50g甲物质充分溶解在50g水中,此时形成的溶液中溶质与溶剂的质量比为_____(填最简整数比)。
-
科目: 来源: 题型:
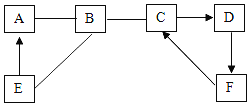
查看答案和解析>>【题目】A~F 是初中化学常见的六种物质,A、B、C、D属于不同类别的物质,A是一种单质,C可用于配制农药波尔多液,E为红棕色固体且与固体F属于同类物质。它们之间的转化关系如图所示(“﹣”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质;反应条件、部分反应物和生成物已略去)。
(1)写出相应物质的化学式:A_____;F_____。(2)写出B与E反应的化学方程式_____;
(3)写出C转化为D的化学方程式_____。
相关试题

