【题目】水在生活、生产中和化学实验中起着十分重要的作用.
Ⅰ.自来水厂净化水的过程为:取水→过滤→吸附→消毒,高铁酸钾(K2FeO4)能用作絮凝剂.
(1)制备K2FeO4的化学方程式为2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6X+8H2O,则X的化学式为 ,K2FeO4中铁元素的化合价为
(2)自来水厂净化水的过程 (填“能”、“不能”)将硬水软化成软水.
Ⅱ.欲证明一瓶无色透明液体是纯净水,可靠的实验方法是
A.1.01×105Pa时沸点为100℃
B.测得其pH=7
C.电解时得到H2与O2的体积比为2:1
Ⅲ.请根据如图实验现象并结合溶解曲度线回答(其中甲、乙、丙均不含结晶水)
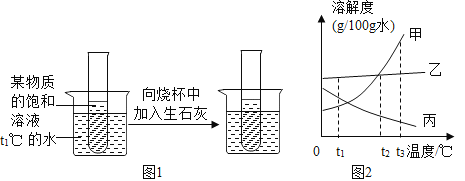
(1)生石灰与水反应的化学方程式为 ,试管内所盛饱和溶液的溶质为对应溶解曲度线中的 (填甲、乙、丙)
(2)如果要配制相同浓度的甲、乙饱和溶液,需要把温度控制在 ℃
(3)t3℃时,将甲、乙、丙的饱和溶液都降温到t1℃,溶液中溶质质量分数由小到大的顺序为 .
参考答案:
【答案】Ⅰ、(1)KCl+6(2)不能
Ⅱ、A
Ⅲ、(1)CaO+H2O═Ca(OH)2丙(2)t2(3)丙<甲<乙
【解析】
试题分析:Ⅰ、(1)根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6X+8H2O,可以推出X化学式为KCl;根据元素化合价的一般规律:在化合物中,正负化合价的代数和为0,在K2FeO4中K的化合价为+1,O的化合价为-2,故Fe的化合价为+6。
(2)自来水厂净化水的过程只是除去水中的不溶性杂质以及一些可溶性杂质,但并不能将硬水软化成软水,需通过加热煮沸或蒸馏。
Ⅱ、A、物质的沸点是固定的,故1.01×105Pa时沸点为100℃,可证明是纯净水,正确,B、有的盐溶液也显中性,错误,C、电解水时,可以加入氢氧化钠或硫酸以增强水的导电性,仍然得到H2与O2的体积比为2:1,错误,故选A。
Ⅲ、(1)生石灰与水反应的化学方程式为:CaO+H2O═Ca(OH)2;因为氧化钙与水反应会放出大量的热,使温度升高,而溶质从溶液中结晶析出,说明该物质的溶解度随温度的升高而降低,故试管内所盛饱和溶液的溶质为对应溶解曲度线中的丙。
(2)根据溶解度曲线图,在t2℃甲、乙两物质的溶解度相等,故如果要配制相同浓度的甲、乙饱和溶液,需要把温度控制在t2℃。
(3)根据溶解度曲线,物质甲、乙的溶解度都随温度的升高而增大,故将t20C时a、b两种物质的饱和溶液分别降温到t10C时,都有晶体析出,成为t10C时的饱和溶液,而在t10C 时:乙的溶解度大于甲,故溶质质量分数乙也大于甲,而对于丙而言,溶解度随温度的升高而降低,故t30C降温到t10C,饱和溶液变为不饱和溶液,但溶液中的溶质、溶剂质量都不变,而物质丙在t30C的溶解度要小于t10C时甲的溶解度,故丙的溶质质量分数最小,故若将t30C三种物质的饱和溶液分别降温到t10C时,则三种溶液中溶质的质量分数大小关系是:丙<甲<乙。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用双氧水制取氧气时,若忘记加二氧化锰,其结果是
A.不放出氧气 B.放出氧气的速度慢
C.放出氧气的总量会减少 D.放出的氧气不纯
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验现象描述错误的是
A.加热高锰酸钾,放出的气体能使带火星的木条恢复燃烧
B.把红热的木炭放入盛有氧气的集气瓶中,剧烈反应,生成使石灰水变浑浊的气体
C.硫在氧气中燃烧,发出白光,产生有刺激性气味的气体
D.红磷燃烧生成大量白烟
-
科目: 来源: 题型:
查看答案和解析>>【题目】从微观角度了解物质及其变化,更有助于认识物质组成和变化的本质.
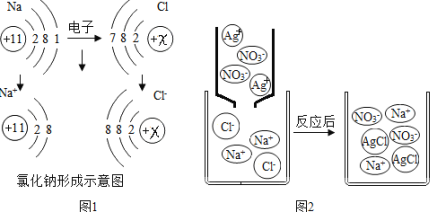
(1)图1是钠原子和氯原子形成氧化钠的示意图:
图中x= ,从得失电子的角度看,氯原子得到电子达到稳定结构后,其化合价将 (填“升高”或“降低”)
(2)图2是NaCl溶液与AgNO3溶液反应的微观示意图:
你在实验中会观察到的现象是 ,结合图2该反应的实质是 结合生产沉淀,写出与上述反应本质相同的另一化学方程式 (反应物之一为AgNO3)
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:
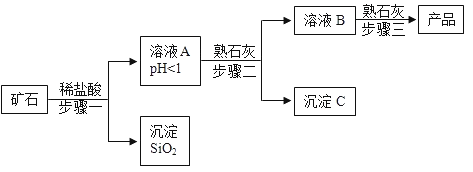
(1)请写出步骤一中发生反应的化学方程式: (任写一个)
(2)溶液A中所含的阳离子有 (填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
沉淀物
Fe(OH)2
Cu(OH)2
Mg(OH)2
开始沉淀
1.9
4.2
9.1
完全沉淀
3.2
6.7
11.1
步骤二中加入熟石灰,调节溶液的pH范围为
(4)3个步骤中均用到的操作是
(5)步骤三中生成产品的化学方程式为 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】可以作为溶质的 ( )
A.只有固体 B.只有液体
C.只有气体 D.气体、液体、固体都可以
-
科目: 来源: 题型:
查看答案和解析>>【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
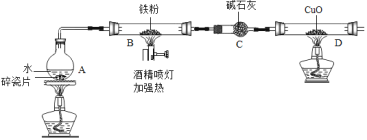
(1)【推断】观察到D中黑色固体变红,则B中生成的气体是 (2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是
【实验探究】
实验操作
实验现象及结论
【实验结论】铁与水蒸气反应的化学方程式为
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为 .
相关试题

