【题目】某化学小组初步设计了“收集不同体积比例的二氧化碳和一氧化碳混合气体”的实验方案(部分夹持装置及导管已略去)。请回答下列问题:

方案一:如图1所示
(1)请写出硬质玻璃管中发生反应的化学方程式:___________。
(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是____。
方案二:如图2所示
(3)请写出该气体与炭粉发生反应的化学方程式:_____。
方案三:如图3所示
(4)写出装置A中发生反应的化学方程式:___。
(5)装置B的作用:______。
(6)CO气体应由___(填“a”或“b”)通入。
(7)写出装置C中浓硫酸的两点主要作用:①__________;②________。(答对一点即得分)
该化学小组用图示的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
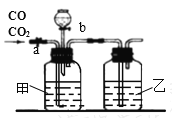
(8)甲瓶内盛__________溶液,分液漏斗内盛__________,乙瓶中盛__________。
(9)实验先分离出________,方法是先关闭b,再打开a。
(10)再收集_________,方法是先关闭a,再打开b。
参考答案:
【答案】 3CO + Fe2O3![]() 2Fe + 3CO2 CO过量 CO2 + C
2Fe + 3CO2 CO过量 CO2 + C![]() 2CO CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O 除去HCl b 干燥 通过两者产生的气体数量可观察两种气体体积比例 NaOH 稀硫酸(稀盐酸) 浓硫酸 CO CO2
2CO CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O 除去HCl b 干燥 通过两者产生的气体数量可观察两种气体体积比例 NaOH 稀硫酸(稀盐酸) 浓硫酸 CO CO2
【解析】(1)硬质玻璃管中一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)该实验过程中实验前要选通CO,实验结束后要继续通CO至试管冷却,则说明CO是过量的,与生成的二氧化碳组成混合气体;
(3)在高温的条件下,二氧化碳与碳反应生成一氧化碳,故填:CO2+C![]() 2CO;
2CO;
(4)大理石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳,反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;
(5)装置B中饱和碳酸氢钠可以吸收HCl并生成CO2,则B的作用是除去HCl;
(6)一氧化碳气体要能进能出,所以要从b管进入;故填:b;
(7)浓硫酸具有吸水性,用于干燥二氧化碳,并能根据导管口的气泡来分析气体组成;
(8)依据实验要求可知甲、乙装置应分别为除杂和干燥装置,根据CO和CO2性质可知甲是用以吸收CO2的,因此甲、乙应分别装NaOH溶液和浓H2SO4,甲吸收CO2后最后还应将其释放出来,显然b中应盛放酸,由于盐酸有挥发性,宜选择H2SO4;
(9)根据(1)的分析可知当关闭b打开a时NaOH溶液能吸收CO2,则先分离得到的是CO气体;
(3)打开b让硫酸和碳酸钠反应生成二氧化碳,关闭a防止再进入CO,最终收集到CO2气体。
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用下列各组物质之间的反应,能够验证Fe、Cu、Ag三种金属活动性顺序的是( )
A. Fe、CuCl2溶液、Ag B. FeCl2溶液、CuCl2溶液、Ag
C. FeCl2溶液、Cu、Ag D. Fe、Cu、Ag、H2SO4溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)用化学用语填空:
①3个硫原子__; ②硝酸分子__; ③氢氧化铝中铝元素的化合价________;
④ 人体缺乏后会引起贫血的元素__ ;
(2)生活与化学密切相关,生活中处处有化学,请你根据所学化学知识回答下列问题:
⑤生铁制品生锈是铁与______共同作用的结果。铁锈成分复杂,主要成分是______(写化学式),生活中可用__(物理方法)工业中可用__(化学方法,用化学方程式表示)除去铁锈的方法 。
⑥氢能源是清洁的绿色能源,燃烧的化学方程式为:___________。
机动车轮胎属于__材料(填无机,合成,复合)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图中的物质为初中化学常见物质,他们之间的反应关系如图所示(“→”表示转化关系,“﹣”表示相互能反应,部分反应物、生成物或反应条件已略去)。

甲与A溶液反应得到浅绿色溶液;A、B发生中和反应,产物之一是厨房内常用的调味品;C常用于改良酸性土壤,且C的溶液与D的溶液反应可得到B;C的溶液与乙的溶液反应生成蓝色沉淀;乙与丙两种溶液反应生成两种不同颜色的沉淀。请回答:
(1)甲的化学式是 ;D的化学式是 。
(2)欲通过一步实验证明A、B是否恰好完全反应,需要向A、B反应后的溶液中加入的试剂是 。
(3)E→C反应的化学方程式是 。
(4)乙与丙两种溶液反应的化学方程式是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水和空气都是人类赖以生存的基础,保护空气和水资源,是每个公民和全社会的责任,下列各项措施中,可以减少大气、水污染的措施是
①控制工业“废水”和生活污水的直接排放 ②多使用清洁燃料,减少PM2.5的排放 ③植树、种草、增大绿化面积 ④禁止使用含磷洗衣粉 ⑤禁止施用农药和化肥
A.①④⑤ B.①③④ C.①②③④ D.①②③④⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用如图所示的实验装置制备常见气体,请回答有关问题:
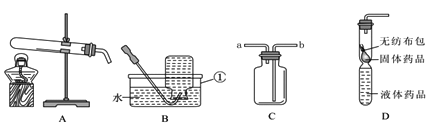
(1)写出标有序号的仪器名称:①___。
(2)装置A为制取氧气的发生装置,写出有关反应的化学方程式_____。
(3)若用装置B收集的氧气不纯,原因可能是____(写一种)。
(4)用装置C收集氧气,验满时将带火星的木条放在___(选填“a”或“b”)处。
(5)装置D是用软塑料管自制的气体发生装置,利用该装置制取二氧化碳气体时,塑料管中 加入的液体药品是___,药品加入完毕后,接下来的操作是:_______。该装置的优点_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】企业宣传活动,通常采用大型遥控飞艇作广告。为了安全,艇内冲入的气体最好是
A.氢气 B.氧气 C.氦气 D.二氧化碳
相关试题

