【题目】KNO3和NaCl的溶解度表及溶解度曲线如下,下列说法错误的是( )
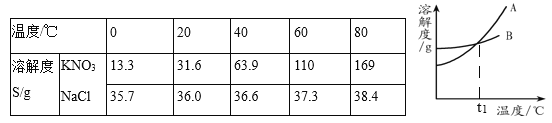
A. t1介于20℃-40℃之间
B. 50℃时,溶液的溶质质量分数:KNO3>NaCl
C. 当KNO3中混有少量NaCl时,可用降温结晶的方法提纯
D. 60℃时,30g KNO3加入50g水,充分溶解,再降温到20℃,会析出晶体14.2g
参考答案:
【答案】B
【解析】A. t1℃,两种物质的溶解度相等,介于20℃-40℃之间,正确;B. 50℃时,饱和溶液的溶质质量分数:KNO3>NaCl,错误;C. 溶解度受温度影响较大的物质,用降温结晶的方法提纯,正确;D. 60℃时,50g水能溶解55gKNO3,20℃,50g水能溶解15.8gKNO3,析出晶体的质量是30g-15.8g=14.2g,正确。故选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣小组在吴老师的指导下,借助紫甘蓝汁液进行中和反应实验。
【演示实验】取少许久置的NaOH溶液,并滴入几滴紫甘蓝汁液(溶液由紫变黄);然后向黄色NaOH溶液中逐滴加入稀盐酸,发现溶液中冒气泡,且溶液从下至上依次呈现黄色、绿色、蓝色、紫色、粉红、深红色等,宛若彩虹、非常美丽。
探究Ⅰ:为什么反应过程中溶液里呈现多彩的颜色
【进行猜想】
小彤猜想:可能是反应过程中,溶液中各部位紫甘蓝汁液的浓度不同。
小哲猜想:可能是反应过程中,溶液中各部位的酸碱度(pH)不同。
【实验验证】
(1)在小烧杯中加入少许紫甘蓝汁液,然后逐渐加入适量的水,溶液始终是紫色。
(2)在另一个小烧杯中加入适量新配制的NaOH溶液,然后逐滴加入稀盐酸,及时观察溶液颜色的变化,同时用传感器测出反应过程中溶液pH的变化,绘制溶液pH及颜色的变化图(如图所示)。读图可知,______________________的猜想是正确的。

【拓展延伸】结合图像思考:
(1)当酸碱恰好完全中和时,溶液呈____________________色;
(2)当溶液呈红色时,对应溶液中的溶质是________________。
探究Ⅱ:久置的NaOH溶液的溶质成分
【查阅资料】CaCl2溶液显中性。
【实验验证】
(1)小宇认为,因为向久置的NaOH溶液中滴加稀盐酸时产生了气泡,所以该溶液已变质。请用化学方程式表示NaOH溶液变质的原因:___________________________________。
(2)小文取少量久置的NaOH溶液,滴入足量CaCl2溶液,产生白色沉淀;再向上层清液中滴入几滴紫甘蓝汁液,溶液显黄色。因此,这瓶久置的NaOH溶液的溶质成分是_____________。
【评价反思】作为酸碱指示剂,紫甘蓝汁液与紫色石蕊溶液相比,优点明显,它既能测出溶液的酸碱性,还能显示溶液的___________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化钠(Na2O2)是一种供氧剂,与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑。将10g含过氧化钠78%的过氧化钠样品(只含有NaOH杂质)加入到85.2g质量分数为10%的氢氧化钠溶液中充分反应(水的挥发忽略不计)。请计算:
(1)生成氧气的质量。
(2)反应后所得溶液中溶质的质量分数。
(3)若将反应后的溶液的溶质质量分数恢复到10%,需加入水的质量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】烧杯中有CaCl2与稀HCl的混合溶液50g,向烧杯中逐渐加入10.0% Na2CO3溶液,所得溶液的质量与所滴加Na2CO3溶液质量关系如图(不考虑生成气体在溶液中的溶解和其他物质的挥发)。下列说法正确的是( )
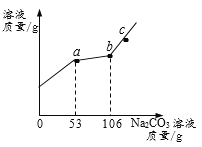
A. a-b段产生气体
B. c点溶液的pH>7
C. b点时烧杯中物质的总质量为148.8g
D. a到b过程中,溶液中NaCl的质量分数在不断增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】除去下列物质中的杂质(括号中的为杂质),所用试剂错误的是
选项
A
B
C
D
物质
CO2(CO)
CO2(HCl)
Cu(CuO)
KCl(MnO2)
除杂试剂
CuO
NaOH溶液
稀盐酸
H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述中,正确的是( )
A. 红磷在空气中燃烧产生大量白雾 B. 对着干燥的玻璃片哈气无明显现象
C. 氯化钠在溶解的过程中溶液温度升高 D. 蜡烛刚熄灭时的白烟可以点燃
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是
A.浓盐酸 B.浓硫酸 C.澄清石灰水 D.氢氧化钠溶液
相关试题

