【题目】化学兴趣小组对某种粗锌(主要成分为锌,杂质不与酸反应)样品中锌的含量进行了测定。如图所示,称20 g该粗锌样品置于烧杯(质量为58.8 g)中,加入100 g足量稀硫酸,待粗锌完全反应后,称得烧杯及烧杯中剩余物总重量为178.4 g。

(1)硫酸(H2SO4)中氢、硫、氧三种元素的质量比为 。
(2)反应过程中产生氢气的质量为 g。
(3)计算该粗锌样品中锌的质量分数(写出计算过程及结果)。
参考答案:
【答案】(1)1:16:32;(2)0.4; (3)65%
【解析】
试题分析:(1)硫酸(H2SO4)中氢、硫、氧三种元素的质量比为1×2:32:16×4=1:16:32
(2)根据质量守恒定律可知质量减少的质量即为反应过程中产生氢气的质量:100g+20g+58.8g-178.4g=0.4
(3)解:设锌的质量为x
Zn+H2SO4===ZnSO4+H2↑
65 2
x 0.4 g
65:2=x:0.4g
x=13 g
锌的质量分数=13g/20g ×100%= 65%
答:锌的质量分数为65%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分类是科学探究的重要方法,下列物质所属类别不正确的是( )
选项
A
B
C
D
物质
尿素
液态氧气
冰
氯化铵
类别
无机物
单质
氧化物
盐
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验方案正确的是( )
序号
实验目的
实验方案
A
除去氯化氢中的水蒸气
通过足量的氢氧化钠固体
B
检验某气体是否为二氧化碳
用燃着的木条伸入该气体中
C
除去硫酸钾溶液中的硫酸镁
滴加适量的氢氧化钠溶液
D
不用其它试剂,鉴别①稀硫酸②氢氧化钠溶液③氯化铁溶液
鉴别出的先后顺序可以是③②①
-
科目: 来源: 题型:
查看答案和解析>>【题目】某小组同学探究二氧化碳(CO2)、氨气(NH3)分别与水反应后产物的酸碱性。他们收集了若干瓶CO2和NH3。
【确定标准】
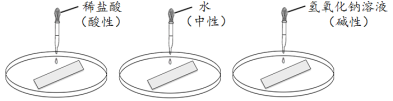
老师指导该小组同学用自制的紫色石蕊试纸完成了如上图所示实验,确定检验酸碱性物质存在的标准。取三个洁净的表面皿,分别放上紫色石蕊试纸,向试纸上依次滴加稀盐酸、蒸馏水、氢氧化钠(碱)溶液,观察到三条试纸的颜色依次为红色、紫色和蓝色。
【实验过程】
(1)探究CO2与水反应产物的酸碱性。该小组同学向一瓶CO2中加入30 mL水,充分振荡。再取一个洁净的表面皿,放上一条紫色石蕊试纸,向试纸上滴加瓶中的液体,观察到紫色石蕊试纸变成红色,由此获得结论:瓶中液体里含有 性物质,发生反应的化学方程式为 。
(2)探究NH3与水反应产物的酸碱性。该小组同学用(1)的方法继续进行NH3的实验,他们分析液体里含有碱性物质,观察到的现象是 ,分析依据是 。
【实验反思】
有同学提出:仅用上述实验还不足以说明CO2或NH3与水发生了反应,还需补充一个对比实验,以NH3为例,该对比实验的操作为 ,观察到的现象为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学在探究燃烧的条件时,做了如下实验。请参考小资料回答问题。

(1)图中,V型玻璃管的中间用耐高温绝热材料将两边隔开,管的两端分别放置白磷(块状)和红磷(粉末)。将V型管放到盛有开水的烧杯中进行水浴加热,可以观察到的现象是 (填字母序号)。

A.白磷燃烧,红磷不燃烧 B.白磷不燃烧,白磷燃烧
C.白磷先燃烧,红磷后燃烧 D.红磷先燃烧,白磷后燃烧
(2)图中,V型玻璃管的底部放置的白磷(块状)和红磷(粉末)相互接触但不混合,将V型管放到盛有开水的烧杯中水浴加热,可以观察到的现象是 (填字母序号)。
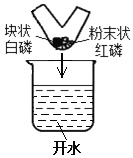
A.白磷燃烧,红磷不燃烧 B.白磷不燃烧,白磷燃烧
C.白磷先燃烧,红磷后燃烧 D.红磷先燃烧,白磷后燃烧
上述两个实验能够证明燃烧需要的条件是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】山梨酸及山梨酸钾是国际粮农组织推荐的高效安全的防腐保鲜剂,它们之间的转化反应为:C6H8O2+KOH===C6H7O2K+X。则X的化学式为
A.H2 B.O2 C.H2O D.H2O2
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用下图装置在实验室模拟炼铁,并将得到的尾气中的一氧化碳和二氧化碳进行分离和收集。(提示:NaOH溶液可以吸收CO2气体。)
实验步骤如下:

(1)检查装置气密性。
(2)取一定质量的氧化铁加入硬质玻璃管中,其它容器中各加入适量试剂(如图所示)。
(3)关闭分液漏斗开关和K2,打开K1,通入CO气体一段时间,排除装置内的空气。此时装置存在的缺陷是 。
(4)继续通CO,在出口M处将气体干燥并用小试管收集后检验气体纯度。待装置内气体纯净后,打开分液漏斗开关K,将足量的氢氧化钠溶液放入锥形瓶中,使液面没过导管下端,关闭开关K,点燃酒精喷灯,装置A的玻璃管中反应的化学方程式是 。当装置C中的现象是____________时,说明装置B中的反应是充分的,立即关闭K1,打开K2,装置D中收集到的气体是CO。
(5) 一段时间后,停止加热,继续通CO气体至装置A的药品冷却。经称量氢氧化钠溶液增重2.64 g,此时生成Fe的质量是__________g(结果精确到0.1g)。
相关试题

